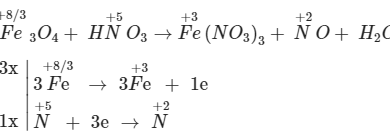FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O là phản ứng oxi hóa khử được Trường TCSP Mẫu giáo – Nhà trẻ Hà Nội biên soạn, phương trình này sẽ xuất hiện trong nội dung các bài học Hóa học 10, cũng như các dạng bài tập. Mời các bạn tham khảo.
Phương trình phản ứng FeS2 tác dụng HNO3
3FeS2 + 26HNO3 → 3Fe(NO3)3 + 6H2SO4 + 17NO + 7H2O
Điều kiện để FeS2 + HNO3
Không có
Cân bằng phản ứng FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
a. Xác định sự thay đổi số oxi hóa:
Fe+2 → Fe+3
S-2 → S+6
N+5→ N+2
(Viết số oxi hóa này phía trên các nguyên tố tương ứng)
b. Lập thăng bằng electron:
Fe+2 → Fe+3 + 1e
S-2 → S+6 + 8e
FeS → Fe+3 + S+6 + 9e
N+5 + 3e → 2N+2
→ Có 3FeS và 9NO.
c. Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại:
3FeS2 + 26HNO3 → 3Fe(NO3)3 + 6H2SO4 + 17NO + 7H2O
Cách tiến hành để FeS2 + HNO3
Cho FeS2 tác dụng với acid HNO3.
Hiện tượng phản ứng hóa học cho FeS2 tác dụng với acid HNO3
Sau phản ứng xuất hiện khí không màu (NO) hóa nâu trong không khí.
Ứng dụng của FeS2
Phổ biến trong sử dụng để làm cơ chế đánh lửa bằng bánh xe trong các dạng súng cổ.
Pyrit được sử dụng ở quy mô thương mại trong sản xuất lưu huỳnh đioxit, có ứng dụng trong các ngành công nghiệp như sản xuất giấy, axít sunfuric, mặc dù vai trò của các ứng dụng này đang bị suy giảm.
Câu hỏi vận dụng liên quan
Câu 1. Cho các chất sau: FeS, FeS2, FeO, Fe2O3. Chất có hàm lượng sắt lớn nhất.
A. FeS
B. FeS2
C. FeO
D. Fe2O3
Đáp án C
Câu 2. Cho 3,6 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra 2,24 lít khí X (sản phẩm khử duy nhất, đktc). Khí X là:
A. N2O5
B. NO
C. N2O
D. NO2
Đáp án B
Ta có:
nMg = 3,6/24 = 0,3 mol
nX = 2,24/22,4 =0,1 mol
Mg0 → Mg+2 +2e
0,15 → 0,3
N+5 + (5 – n) e → N+n
0,3 → 0,1
=> 0,1 (5-n) = 0,3 => n = 2 => NO
Câu 3. Cho 13,7 g hỗn hợp hai kim loại Al và Fe vào dung dịch HNO3 loãng dư, thu được 26,88 lit khí NO (đktc) duy nhất. Khối lượng (g) của Al và Fe trong hỗn hợp đầu là:
A. 2,7; 11
B. 8,1; 5,6
C. 5,6; 8,1
D. 11; 2,7
Đáp án B
Câu 4. Dãy kim loại nào dưới đây không phản ứng với axit HNO3 đặc nguội?
A. Cu, Fe, Ag
B. Cu, Fe, Cr
C. Cr, Fe, Al
D. Fe, Cr, Ag
Đáp án C: Al, Fe, Cr là những kim loại bị thụ động với HNO3 đặc nguội
Câu 5. Dãy chất nào dưới đây gồm các chất vừa có tính oxi hóa vừa có tính khử?
A. SO2, O3, dung dịch H2SO4 (loãng)
B. SO2 , Cl2, F2
C. O2, SO2, Cl2
D. Cl2, SO2, Br2
Đáp án D
Câu 6. Cho m (g) hỗn hợp Fe và Cu tác dụng hết với 100 ml dung dịch HNO3 2,4 M có nung nóng thu được dung dịch A và một khí màu nâu đỏ. Cô cạn dung dịch A thu được 10,48 g hỗn hợp 2 muối khan. Giá trị của m (g)?
A. 3,04 gam
B. 6,08 gam
C. 1,52 gam
D. 4,56 gam
Đáp án A
nHNO3 = 0,1.2,4 = 0,24 mol;
2H+ + NO3– + e → NO2 + H2O
nNO3- tạo muối = 0,12 mol
mmuối = m + mNO3– = m + 0,12.62 ⇒ m = 10,48 – 7,44 = 3,04 gam
Câu 7. Hòa tan hoàn toàn hh X gồm 8,1 gam Al và 29,25 gam Zn bằng dd HNO3 12,6% (vừa đủ) thu được V lit N2O (đktc, khí duy nhất) và dung dịch Y chứa 154,95 gam muối tan. Giá trị của V là
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Đáp án B
mAl(NO3)3 = 8,1.213/27 = 63,9 gam; mZn(NO3)3 = 29,25.189/65 = 85,05 gam
my = mAl(NO3)3 + mZn(NO3)2 + mNH4NO3 ⇒ mNH4NO3 = 6 gam ⇒ nNH4NO3 = 0,075 mol
nN2O = (0,3.3 + 0,45.2 – 0,075.8)/8 = 0,15 mol ⇒ V = 0,15.22,4 = 3,36 lít
Câu 8. Hòa tan 38,4 gam Cu vào dung dịchHNO3 loãng dư, thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V:
A. 2,24 lít
B. 3,36 lít
C. 8,96 lít
D. 6,72 lít
Đáp án C. Sử dụng bảo toàn e: nNO = 38,4/64 . 2/3 = 0,4 mol ⇒ V = 0,4.22,4 = 8,96 lít
Câu 9. Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí người ta thu được sản phẩm gồm
A. FeO, NO2, O2.
B. Fe2O3, NO2.
C. Fe, NO2, O2.
D. Fe2O3 ,NO2 ,O2.
Đáp án D
Phương trình phản ứng
4Fe(NO3)2 2Fe2O3 + 8NO2 + O2
Câu 10. Nhận định nào sau đây không đúng?
A. Axit nitric phản ứng với tất cả bazơ.
B. Axit nitric (loãng, đặc, nóng) phản ứng với hầu hết kim loại trừ Au, Pt.
C. tất cả các muối amoni khi nhiệt phân đều tạo khí amoniac.
D. Hỗn hợp muối nitrat và hợp chất hữu cơ nóng chảy có thể bốc cháy.
Đáp án C
Trên đây tmdl.edu.vn vừa giới thiệu tới các bạn phương trình hóa học FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O. Hy vọng với bộ tài liệu này có thể giúp bạn học tốt môn hóa. cảm ơn các bạn đã theo dõi bài viết.
Chúc các bạn học tập tốt.
Bản quyền bài viết thuộc Tmdl.edu.vn. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá (tmdl.edu.vn)