Nhôm (AL) nhờ vào đặc tính vật lý dẫn điện, dẫn nhiệt, nhẹ và dễ rát mỏng là một trong những nguyên tố kim loại quan trọng được ứng dụng rất nhiều trong đời sống. Trong bài này chúng ta sẽ cùng tìm hiểu về tính chất hoá học của một kim loại cụ thể, đó là Nhôm Al.
Tính chất vật lý của nhôm Al
Nhôm là kim loại nhẹ (D = 2,7 g/cm3), nóng chảy ở 660°c.
Nhôm là kim loại màu trắng bạc, có ánh kim, dẫn điện và dẫn nhiệt tốt.
Nhôm có tính dẻo nên có thể cán mỏng và kéo thành sợi.

Tính chất hoá học của Nhôm Al
Nhôm Phản ứng với phi kim
Nhôm Tác dụng với nước
Nhôm Phản ứng với dung dịch axit
Nhôm Phản ứng với dung dịch muối
Nhôm Phản ứng với dung dịch kiềm
Nhôm tác dụng với oxi và một số phi kim.
a) Nhôm tác dụng với oxi
4Al + 3O2 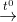 2Al2O3
2Al2O3
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
b) Nhôm phản ứng với phi kim khác
2Al + 3Cl2 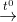 2AlCl3
2AlCl3
2Al + 3S 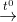 Al2S3
Al2S3
Nhôm tác dụng với axit
Nhôm tác dụng với axit HCl, H2SO4 loãng tạo thành muối nhôm và giải phóng khí Hyđro
2Al + 6HCl → 2AlCl3 + 3H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Nhôm tác dụng với axit HCl, H2SO4 đặc, nóng (tuỳ theo nồng độ của axit mà sản phẩm tạo ra có khác nhau).
8Al + 30HNO3 đặc, nóng → 8Al(NO3)3 + 3N2O↑ + 15H2O
Al + 6HNO3 đặc, nóng → Al(NO3)3 + 3NO2 + 3H2O
8Al + 15H2SO4 đặc, nóng → 4Al2(SO4)3 + 3H2S↑ + 12H2O
2Al + 6H2SO4 đặc, nóng → Al2(SO4)3 + 3SO2 + 3H2O
Chú ý: Nhôm không tác dụng với H2SO4, HNO3 đặc, nguội.
Nhôm tác dụng với nước
Thông thường vật bằng nhôm không tác dụng với nước vì có lớp màng Al2O3 không cho nước thấm qua, nếu phá bỏ lớp màng này thì Al tác dụng với nước.
2Al + 6H2O → 2Al(OH)3 + 3H2↑
Nhôm tác dụng với dung dịch muối
Nhôm phản ứng với dụng dịch muối của kim loại yếu hơn (trong dãy điện hoá) tạo thành muối mới và giải phóng kim loại yếu ra khỏi muối.
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu↓
2Al +3FeCl2 → 2AlCl3 + 3Fe↓
Nhôm phản ứng với dung dịch kiềm
Lớp oxit nhôm dễ bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Nhôm tác dụng với oxit kim loại
Ở nhiệt độ cao Nhôm khử được một số oxit kim loại (đứng sau nhôm trong dãy điện hoá) gọi là phản ứng nhiệt nhôm.
2Al + Fe2O3 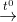 2Fe + Al2O3
2Fe + Al2O3
2Al + 3CuO 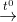 3Cu + Al2O3
3Cu + Al2O3
Ứng dụng của Al
Ứng dụng của nhôm. Nhôm có rất nhiều ứng dụng trong cuộc sống. Kim loại này được các thương hiệu nhôm tại Việt Nam dùng để tạo thành vỏ máy bay do độ bền chắc và mỏng nhẹ của nó. Nhôm cũng được dùng để sản xuất các thiết bị và dụng cụ sinh hoạt như nồi, chảo, các đường dây tải điện, các loại cửa,…
Bài tập vận dụng tính chất hoá học của nhôm Al
Bài 1: Hoà tan 9,14g hỗn hợp Cu, Mg, Al bằng dung dịch HCl dư thu đợc 7,84 lít khí A (đktc); 2,54g chất rắn B và dung dịch C. Tính khối lượng muối có trong dung dịch C.
Hướng dẫn:
Khi cho hỗn hợp vào HCl chỉ có Al, Mg phản ứng
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
Mg + 2HCl → MgCl2 + H2↑ (2)
Khí thu được ra là H2 nên ta có:
nH2 = V/22,4 = 7,84/22,4 = 0,35 mol
nHCl pư = 2.nH2 = 2.0,35 = 0,7 mol
Dung dịch C gồm muối và HCl dư nên theo định luật bảo toàn khối lượng ta có:
mhh + mHCl pư = mmuối + mH2 + mB
⇔ 9,14 + 0,7.36,5 = mmuối +0,35.2 + 2,54
⇒ mmuối = 31,45g
Bài 2: Thực hiện phản ứng nhiệt nhôm giữa 6,48 gam Al với 17,6 gam Fe2O3. Chỉ có phản ứng nhôm khử oxit kim loại tạo kim loại. Đem hòa tan chất rắn sau phản ứng nhiệt nhôm bằng dung dịch xút dư cho đến kết thúc phản ứng, thu được 1,344 lít H2 (đktc). Tính hiệu suất phản ứng nhiệt nhôm.
Hướng dẫn:
Theo bài ra, ta có: nAl = m/M = 6,48/27 = 0,24 mol, nFe2O3 = 17,6/160= 0,11 mol
Ta có PTPƯ:
2Al + Fe2O3 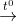 Al2O3 + 2Fe (1)
Al2O3 + 2Fe (1)
2Al dư + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ (2)
Theo bài ta, ta có: nH2 = 1.344/22.4 = 0,06 (mol).
PTPƯ (2) ⇒ nAl dư = (2/3)nH2 = (2/3).0,06 = 0,04 (mol).
⇒ nAl pư = 0,24 – 0,04 = 0,2 (mol).
Theo PTPƯ (1) ta có nFe2O3 = (1/2).nAl = (1/2).0,2 = 0,1 (mol).
⇒ Vậy hiệu suất phản ứng của Fe2O3 là: H = (0,1/0,11).100% = 90,9%
Bài 4 trang 58 sgk hoá 9: Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2. Có thể dùng chất nào sau đây để làm sạch muối nhôm? Giải thích sự lựa chọn.
a) AgNO3. b) HCl.
c) Mg. d) Al. e) Zn.
Lời giải bài 4 trang 58 sgk hoá 9:
Đáp án: d) Al
Dùng Al để làm sạch muối nhôm vì:
2Al + 3CuCl2 → 2AlCl3 + 3Cu↓
Bài tập 6 trang 58 sgk hóa 9: Để xác định phần trăm khối lượng của hỗn hợp A gồm nhôm và magie, người ta thực hiện hai thí nghiệm sau:
Thí nghiệm 1: Cho m gam hỗn hợp A tác dụng với dung dịch H2SO4 loãng dư, thu được 1568ml khí ở điều kiện tiêu chuẩn.
Thí nghiệm 2: Cho m gam hỗn hợp A tác dụng với dung dịch NaOH dư thì sau phản ứng thấy còn lại 0,6g chất rắn.
Tính phần trăm khối lượng của mỗi chất trong hỗn hợp A.
Lời giải bài tập 6 trang 58 sgk hóa 9:
Ở thí nghiệm 2: Do NaOH dư nên Al sẽ tác dụng hết với NaOH, còn Mg không phản ứng nên khối lượng chất rắn còn lại là Mg, mMg = 0,6g.
⇒ nMg = 0,6/24 = 0,025 mol
Ta gọi số mol của Al là x(tức nAl = x); PTPƯ
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ ( 1)
Mg + H2SO4 → MgSO4 + H2↑ (2)
Theo PTPƯ (2) nH2 = nMg = 0,025 mol
Theo PTPƯ (1) nH2 = (3/2). nAl = (3/2). x mol
⇒ Tổng số mol H2 là nH2 = 0,025 + 3x/2 mol (∗)
Theo đề bài ta có: VH2 = 1568ml = 1,568 lít
⇒ nH2 = 1,568/22,4 = 0,07 mol (∗∗)
Từ (∗) và (∗∗) ⇒ 0,025 + 3x/2 = 0,07
Giải ra ta có : x = 0,03 mol ⇒ mAl = 0,03 x 27 = 0,81g
⇒ mhỗn hợp A = 0,81 + 0,6 = 1,41 g
⇒ % mAl = (0,81 x 100%)/1,41 = 57,45%
⇒ % mMg = 100% – 57,45% = 42,55%.
Bài 4 trang 69 sgk hoá 9: Hoàn thành sơ đồ phản ứng
a) Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → Al → AlCl3
Lời giải bài 4 trang 69 sgk hoá 9:
1) 4Al + 3O2 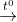 2Al2O3
2Al2O3
2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
3) AlCl3 + 3NaOH vừa đủ → Al(OH)3 + 3NaCl
hoặc AlCl3 + NH3 + H2O → Al(OH)3 + NH4Cl
4) 2Al(OH)3 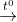 Al2O3 + 3H2O
Al2O3 + 3H2O
5) 2Al2O3 ![xrightarrow[dpnc]{Na_{3}AlF_{6}}](https://tmdl.edu.vn/wp-content/uploads/2022/07/giflatexxrightarrowdpncna_3alf_1546931309-1.gif) 4Al + 3O2
4Al + 3O2
6) 2Al + 3Cl2 → 2AlCl3
Hoặc 2Al + 6HCl → 2AlCl3 + 3H2↑
Hy vọng với phần hệ thống lại tính chất hoá học của nhôm Al ở trên sẽ giúp ích cho các em, mọi thắc mắc hay góp ý, các em vui lòng để lại bình luận dưới bài viết, chúc các em học tập tốt!
Bản quyền bài viết thuộc Tmdl.edu.vn. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá (tmdl.edu.vn)





