Axit sunfuric loãng: tính chất hóa học, công thức, ứng dụng
Như các em đã biết axit sunfuric loãng là một axit vô cơ mạnh, có khả năng hòa tan hoàn toàn trong nước theo bất kỳ tỷ lệ nào, là một trong những thành phần gây mưa axít. Ngoài ra, nó cũng dễ dàng hút ẩm và hấp thụ hơi nước từ không khí. Chủ đề hôm nay chúng ta sẽ nghiên cứu về tính chất hóa học, ứng dụng và công thức của axit sunfuric loãng.
Nội dung chính
Bạn đang xem bài: Axit sunfuric loãng: tính chất hóa học, công thức, ứng dụng
Bài học Axit sunfuric loãng H2SO4
Tính chất hóa học của H2SO4
– Đổi màu quỳ tím thành màu đỏ
– Tác dụng được với kim loại đứng trước H trong dãy hoạt động hóa học để giải phóng khí H2
Zn + H2SO4 → ZnSO4 + H2
– Tác dụng với bazơ và oxit bazơ
H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
H2SO4 + MgO → MgSO4 + H2O
– Tác dụng với muối của axit yếu hơn
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Ứng dụng của axit sunfuric trong đời sống
– Trong đời sống hằng ngày, axit sunfuric có nhiều ứng dụng như:
+ Sản xuất phân bón
+ Làm chất tẩy rửa
+ Ứng dụng làm tơ sợi, thuốc nổ
+ Ứng dụng trong công nghiệp chế biến dầu mỏ….
Công thức H2SO4
Công thức 1: Tính khối lượng muối sunfat thu được khi hòa tan hết 1 hoặc hỗn hợp kim loại (trước hiđro) bằng H2SO4(loãng) tạo H2
m = mhh + 96 * nH2
Công thức 2 : Tìm kim loại khi cho m (gam) kim loại(trước hiđro) tác dụng H2SO4 (loãng) giải phóng H2.
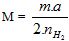
(a= số oxi hóa thấp của kim loại = số e kim loại nhường = hóa trị thấp của kim loại )
Công thức 3:
– (Số mol e trao đổi : Số mol sản phẩm khử = 2) hay (Số mol mol H2SO4 : Số mol e trao đổi = 1) => Sản phẩm khử là SO2
– (Số mol e trao đổi : Số mol sản phẩm khử = 6) hay (Số mol mol H2SO4 : Số mol e trao đổi = 2/3) => Sản phẩm khử là S
– (Số mol e trao đổi : Số mol sản phẩm khử = 8) hay (Số mol mol H2SO4 : Số mol e trao đổi = 5/8) => Sản phẩm khử là H2S
Công thức 4: Tính khối lượng m (gam) muối sunfat thu được khi hòa tan hết m(gam) 1 hoặc hỗn hợp oxit kim loại bằng H2SO4(loãng).
m = moxit + 80 * nH2SO4
Bài tập áp dụng
Bài 1: Hòa tan hết 11,1 gam hỗn hợp 3 kim loại trong dung dịch H2SO4 loãng dư thu được dung dịch A và 8,96 lít khí (đktc).Cô cạn dung dịch A thu được m gam muối khan. m có giá trị là :
A. 59,1 gam B. 35,1 gam C. 49,5 gam D. 30,3 gam
Bài 2: Hòa tan hết 20,608 gam một kim loại M bằng dung dịch H2SO4 loãng dư thu được dung dịch A và V lít khí (đktc). Cô cạn dung dịch A thu được 70,0672 gam muối khan. M là :
A. Na B. Mg C. Fe D. Ca
Bài 3: Cho 13,33 gam hỗn hợp Al,Cu,Mg tác dụng với dung dịch H2SO4 loãng dư thu được dung dịch A, 7.728 lít khí (đktc) và 6,4 gam chất rắn không tan. Cô cạn dung dịch A thu được bao nhiêu gam muối khan ?
A. 40,05 gam B. 42,25 gam C. 25,35 gam D. 46,65 gam
Bài 4: Hòa tan hết hỗn hợp X gồm 0,12 mol Fe và 0,24 mol kim loại M trong dung dịch H2SO4 loãng dư thu được dung dịch A và 10,752 lít khí (đktc). Cô cạn dung dịch A thu được 59,28 gam muối khan. M là?
A. Na B. Mg C. Ca D. Al
Bài 5: Hòa tan 6,76 gam hỗn hợp ba oxit Fe3O4, Al2O3, và CuO bằng 100ml dung dịch H2SO4 1.3 M vừa đủ, thu được dung dịch Y có hòa tan các muối. Cô cạn dung dịch Y thu được m gam hỗn hợp các muối khan. m có giá trị là?
A. 15,47 gam B. 16,35 gam C. 17,16 gam D. 19,5 gam
Bài 6: Cho m gam hỗn hợp A gồm 3 oxit kim loại MgO, ZnO, Fe2O3 hòa tan vừa đủ trong 300 ml dung dịch H2SO4 0,1M, thu được dung dịch Y. Cô cạn dung dịch Y thu được 5,21 gam hỗn hợp các muối sunfat khan. Gía trị của m là?
A. 2,85 gam B.2,30 gam C. 2,35 gam D. 2,81 gam
Bài 7: Cho 2,81 gam hỗn hợp gồm 3 oxit MgO, ZnO, Fe2O3 hòa tan vừa đủ trong 300 ml dung dịch H2SO4 loãng, thu được dung dịch Y. Cô cạn dung dịch Y thu được 5,21 gam hỗn hợp các muối sunfat khan. Nồng độ mol/l của dung dịch H2SO4
A. 0,5 M B. 0,1 M C. 0,3 M D. 0,4 M
Bài 8: Hòa tan hết 1,360 gam hỗn hợp 2 kim loại X, Y trong dung dịch H2SO4 loãng, thu được 0,672 lít khí (đktc) và m gam muối. Gía trị của m là:
A. 2,44 gam B. 4,42 gam C. 24.4 gam D. 4,24 gam
Bài 9: Oxi hóa hoàn toàn 14,30 gam hỗn hợp bột các kim loại Mg, Al, Zn bằng oxi dư thu được 22,3 gam hỗn hợp oxit. Cho lượng oxit này tác dụng hết với dung dịch HCl thì lương muối tạo ra là:
A. 48,90 gam B. 36,60 gam C. 32,050 gam D. 49,80 gam
Bài 10: Hòa tan hoàn toàn 2,81 gam hỗn hợp Fe2O3, MgO, ZnO trong 500 ml dung dịch H2SO4 0,1 M (vừa đủ). Sau phản ứng, khối lượng hỗn hợp muối khan khi cô cạn là:
A. 3,81 gam B. 4,81 gam C. 5,81 gam D. 6,81 gam
Bài 11: Cho 55,2 gam hỗn hợp X gồm 2 oxit kim loại FeO và Al2O3 tan vừa đủ trong 700ml dung dịch H2SO4 2M . Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Gía trị của m là:
A. 98,8 gam B. 167,2 gam C. 136,8 gam D. 219,2 gam
Bài 12: Cho 2,54 gam hỗn hợp Y gồm 3 oxit FeO, MgO, Al2O3 tan vừa đủ trong 300 ml dung dịch H2SO4 0,2M. Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Gía trị của m là:
A. 7,34 gam B. 5,82 gam C. 4,94 gam D. 6,34 gam
Bài 13: Cho 38,3 gam hỗn hợp 4 oxit kim loại Fe2O3, MgO, ZnO và Al2O3 tan vừa đủ trong 800 ml dung dịch H2SO4 1M. Cô cạn dung dịch thì thu được a gam muối khan. Gía trị của a là:
A. 68,1 gam B. 86,2 gam C. 102,3 gam D. 93,3 gam
Bài 14: Khi hòa tan một oxit kim loại hóa trị II bằng một lượng vừa đủ dung dịch H2SO4 9,8% thì thu được dung dịch muối có nồng độ 14,8%. Công thức phân tử của oxit kim loại là:
A. CaO B. CuO C. MgO D. BaO
Bài 15: Cho 29 gam hỗn hợp Mg,Zn,Fe tác dụng hết với dung dịch H2SO4 loãng thấy thoát ra V lít khí (đktc). Cô cạn dung dịch sau phản ứng thu được 86,6 gam muối khan. Gía trị của V là:
A. 6,72 lít B. 13,44 lít C. 22,4 lít D. 4,48 lít
Bài 16: Hòa tan hoàn toàn 5,95 g hỗn hợp hai kim loại Al và Zn bằng dung dịch H2SO4 loãng thì khối lượng dung dịch tăng 5,55 gam. Khối lượng Al và Zn trong hỗn hợp lần lượt là:
A. 2,95g và 3g B. 4,05g và 1,9g C. 3,95g và 2g D. 2,7g và 3,25g
Bài 17: Để trung hòa 50 ml dung dịch NaOH 1,2 M cần V(ml) dung dịch H2SO4 30% (D=1,222 g/ml). Giá trị của V là?
A. 8,02 B 7,02 C 9,02 D 6,02
Hướng dẫn:
- Cách viết cấu hình e.
Chúng ta đã tìm hiểu xong về axit sunfuric loãng, và một số bài tập áp dụng công thức tính nhanh ở trên, giúp các em xử lí những bài tập trắc nghiệm nhanh hơn để tiết kiệm thời gian trong thi cử cũng như trong quá trình học. Ngoài ra chúng ta cũng hiểu biết hơn về những ứng dụng thực tiễn của axit sunfuric loãng trong công nghiệp cũng như trong cuộc sống hàng ngày.
tmdl.edu.vn. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/axit-sunfuric-loang-tinh-chat-hoa-hoc-cong-thuc-ung-dung/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục