Định luật bảo toàn nguyên tố là gì?
Để giải quyết những bài toán hóa học lạ và khó, hay giải quyết nhanh những bài toán hóa học đơn giản. Chủ đề hôm nay chúng ta sẽ tìm hiểu về định luật bảo toàn nguyên tố. Phương pháp này được áp dụng chủ yếu để giải các bài toán có nhiều phản ứng hóa học xảy ra cùng lúc hoặc xảy ra theo nhiều giai đoạn.
Định luật bảo toàn nguyên tố là gì?
– Trong các phản ứng hóa học thông thường, các nguyên tố luôn được bảo toàn như vậy có nghĩa: “Tổng số mol nguyên tử của một nguyên tố X bất kỳ trước và sau phản ứng luôn bằng nhau”.
Bạn đang xem bài: Định luật bảo toàn nguyên tố là gì?
– Mở rộng: tổng khối lượng các nguyên tố tạo thành hợp chất bằng khối lượng của hợp chất đó.
Phương pháp bảo toàn nguyên tố
* Chú ý :
- Để áp dụng tốt phương pháp này, ta nên hạn chế viết phương trình phản ứng mà thay vào đó nên viết sơ đồ phản ứng (sơ đồ hợp thức, có chú ý hệ số), biểu diễn các biến đổi cơ bản của chất (nguyên tố) quan tâm.
- Nên quy về số mol nguyên tố (nguyên tử).
- Đề bài thường cho (hoặc qua dữ kiện bài toán sẽ tính được) số mol của nguyên tố quan tâm → lượng chất (chú ý hiệu suất phản ứng, nếu có).
Các dạng bài thường gặp và phương pháp giải
Oxit kim loại tác dụng với chất khử (CO, H2, Al, C) tạo thành chất rắn mới
* Kiến thức cần nhớ: Các chất khử (CO, H2, Al, C) lấy nguyên tử Oxi trong Oxit kim loại tạo thành sản phẩm khử theo các sơ đồ phản ứng sau:
CO + O → CO2 H2 + O → H2O
2Al + 3O → Al2O3 C + O → CO
Theo định luật bảo toàn khối lượng ta có:
Khối lượng oxit = khối lượng kim loại + khối lượng nguyên tử oxi
Nếu sản phẩm khử là chất khí như CO, CO2, H2 thì khối lượng chất rắn thu được giảm chính bằng khối lượng nguyên tử oxi đã tham gia phản ứng.
Ví dụ 1: Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là
A. 1,120. B. 0,896. C. 0,448. D. 0,224.
(Đề thi Cao đẳng – 2008)
Lời giải:
CO + O → CO2
0,04 mol 0,04 mol
CO2 → CaCO3
0,04 mol 0,04 mol
VCO = 0,04 x 22,4 = 0,896 lít (Đáp án B)
Ví dụ 2: Cho V lít hỗn hợp khí (ở đktc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
A. 0,448. B. 0,112. C. 0,224. D. 0,560.
(Đề thi Khối A – 2008)
Lời giải:
CO + O → CO2
H2 + O → H2O
mgiảm = mO = 0,32g → nO = 0,32:16 = 0,02 mol
nhỗn hợp = nO = 0,02 mol → Vhỗn hợp = 0,02 x 22,4 = 0,448 lít
Hỗn hợp kim loại, oxit kim loại sau nhiều biến đổi hóa học cho ra sản phẩm cuối cùng là oxit kim loại.
* Kiến thức cần nhớ: Ta không cần phải viết tất cả các phản ứng hoá học mà chỉ cần biết các hợp chất có chứa nguyên tố chính sau mỗi phản ứng. Để dễ hiểu hơn thì ta nên viết lại sơ đồ chuỗi phản ứng và quan tâm đến hệ số tỉ lượng để tính toán cho đúng.
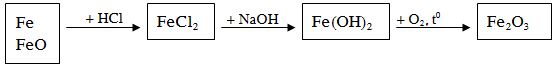
Ví dụ: Hoà tan 10 gam hỗn hợp bột Fe và FeO bằng một lượng dung dịch HCl vừa đủ thấy thoát ra 1,12 lít khí (đktc). Dung dịch thu được cho tác dụng với dung dịch NaOH dư, lọc lấy kết tủa tách ra đem nung trong không khí đến lượng không đổi thu được chất rắn nặng m gam. Giá trị của m là
A. 8 gam B. 16 gam C. 10 gam D. 12 gam
Lời giải:
Fe + 2HCl → FeCl2 + H2
0,05 0,05
mFe = 0,05 x 56 = 2,8g mFeO = 10 – 2,8 = 7,2g
nFeO = nFe(FeO) = 7,2 : 72 = 0,1 mol
Tổng nFe= 0,05 + 0,1 = 0,15 mol
nFe2O3 = 1/2 nFe = 0,075 mol → mFeO = 0,075 x 160 = 12g (Đáp án D)
Kim loại tác dụng với oxi tạo thành oxit kim loại, sau đó cho tác dụng với dung dịch axit
* Kiến thức cần nhớ: Khi kim loại tác dụng với Oxi thì tạo thành oxit kim loại nên khối lượng sẽ tăng lên chính là khối lượng oxi tham gia phản ứng do đó ta có công thức:
mO = moxit – mkim loại
Oxit kim loại tác dụng với dung dịch HCl, H2SO4 loãng tạo thành muối và nước nên có thể biểu diễn bằng sơ đồ phản ứng sau: 2H+ + O2- → H2O
Ví dụ: Đốt cháy hoàn toàn 4,04 gam một hỗn hợp bột kim loại gồm Al, Fe, Cu trong không khí thu được 5,96 gam hỗn hợp 3 oxit. Hòa tan hết hỗn hợp 3 oxit bằng dung dịch HCl 2M. Tính thể tích dung dịch HCl cần dùng.
A. 0,5 lít. B. 0,7 lít. C. 0,12 lít. D. 1 lít.
Lời giải:
mO = moxit – mkim loại = 5,96 – 4,04 = 1,92 gam.
nO = 1.92/16 = 0.12 mol
Hòa tan hết hỗn hợp ba oxit bằng dung dịch HCl tạo thành H2O như sau:
2H+ + O2– → H2O
0,24 <= 0,12 mol
=> VHCl = 0.24/2 =0.12lít. (Đáp án C)
Kim loại tác dụng với dung dịch axit
* Kiến thức cần nhớ: Hỗn hợp kim loại tác dụng với dung dịch axit HCl, H2SO4 loãng tạo thành hỗn hợp muối và khí H2. Từ số mol khí H2 ta suy ra số mol HCl, H2SO4, số mol ion Cl–, SO. Đề bài thường yêu cầu tìm khối lượng muối khan nên ta áp dụng công thức sau: mmuối = mkim loại + mgốc axit
Ví dụ: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một dịch H2SO4 loãng, thu được 1,344 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 9,52. B. 10,27. C. 8,98. D. 7,25.
(Đề thi Cao Đẳng – 2007)
Lời giải:
nH = 1,344 : 22,4 = 0,06 mol
H2SO4 → H2
0,06 mol 0,06 mol
nSO = nHSO = 0,06 mol
mmuối = mkim loại + mgốc axit = 3,22 + 0,06 x 96 = 8,98g (Đáp án C)
Bài toán đốt cháy hợp chất hữu cơ
* Kiến thức cần nhớ: Khối lượng chất hữu cơ bằng tổng khối lượng của các nguyên tố tạo nên chất hữu cơ đó.
mC = (mCO2 / 44) *12 = (VCO2 / 22.4) *12
mH = (mH2O / 18) * 2
mN = (VN2 / 22.4) * 28
Sản phẩm của phản ứng đốt cháy thường là CO2 và H2O được biểu diễn theo phương trình phản ứng sau:
C + O2 → CO2
4H + O2 → 2H2O
Từ hai phương trình phản ứng ta tính được số mol O2 và số mol nguyên tố C, H để tính thể tích oxi hoặc khối lượng chất hữu cơ bị đốt cháy.
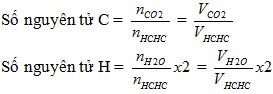
Ví dụ: Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hiđrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là
A. C2H4. B. C3H8. C. C2H6. D. CH4
(Đề thi Khối B -2008)
Lời giải:
Áp dụng công thức trên ta có:
Số nguyên tử C trung bình = 2/1 = 2
Số nguyên tử H trung bình = (2/1) * 2 = 4
Vậy CTPT của hiđrocacbon X là C2H6 (Đáp án C)
Tìm hiểu:
✓ Định luật bảo toàn khối lượng.
Website vừa cung cấp các lý thuyết và bài tập ví dụ liên quan đến định luật bảo toàn nguyên tố. Điểm quan trọng của phương pháp này là ta phải xác định đúng thành phần hóa học chất có chứa nguyên tố hóa học chính mà đề bài cho số liệu liên quan trước và sau phản ứng. Nếu bài toán cho một chất hoặc nhiều chất được biến đổi qua nhiều giai đoạn phản ứng hóa học thì ta sẽ biểu diễn ở dạng sơ đồ phản ứng hoặc phương trình hợp thức để xác định được sự tồn tại của một nguyên tố hóa học trong các chất trước và sau phản ứng. Chúc các em học tốt!
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/dinh-luat-bao-toan-nguyen-to-la-gi/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





