Như các em đã biết, Axit có thể làm đổi chất chỉ thị màu (quỳ tím), Axit tác dụng với kim loại; Axit tác dụng với bazơ, oxit bazơ và axit tác dụng với cả muối.
Ngoài một số bài tập về dạng lý thuyết yêu cầu các em nắm vững tính chất hóa học của axit, thì còn các dạng bài tập về axit tác dụng với kim loại và axit tác dụng với muối; cách giải bài tập này sẽ được minh họa trong bài viết này.
Bạn đang xem bài: Bài tập Axit tác dụng với kim loại, Axit tác dụng với muối – Hóa 9 chuyên đề
* Tóm tắt tính chất hóa học của Axit cần nhớ:
1. Làm đổi màu chất chỉ thị: Dung dịch axit làm đổi màu quỳ tím thành đỏ.
2. Axit tác dụng với kim loại tạo thành muối và giải phóng khí hiđro
Ví dụ: 3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2
Những kim loại không tác dụng với HCl, H2SO4 loãng như Cu, Ag, Hg,…
> Lưu ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng hiđro.
3. Axit tác dụng với bazơ tạo thành muối và nước
Ví dụ: H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
4. Axit tác dụng với oxit bazơ tạo thành muối và nước.
Ví dụ: Fe2O3 + 6HCl → FeCl3 + 3H2O
5. Axit tác dụng với muối (sản phẩm phải có khí bay ra hoặc có chất kết tủa).
Ví dụ: Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
* Bài tập Axit tác dụng với kim loại
• Khi giải bài tập axit tác dụng kim loại cần lưu ý:
– Axit (HCl, H2SO4 loãng) tác dụng với kim loại → Muối + H2↑
(Trừ Cu, Ag, … các kim loại đứng sau Hidro trong dãy điện hóa)
• Phương pháp giải:
– Bước 1: Viết phương trình hóa học,
– Bước 2: Xác định số mol hay lượng chất đề bài cho sẵn.
– Bước 3: Từ phương trình hóa học, áp dụng thêm một số định luật khác như:bảo toàn khối lượng, bảo toàn nguyên tố để giải quyết yêu cầu của bài.
* Bài tập 1: Cho một khối lượng mạt sắt dư vào 50ml dung dịch HCl. Phản ứng xong thu được 3,36 lít khí (đktc).
Xem lời giải
• Đề bài: Cho một khối lượng mạt sắt dư vào 50ml dung dịch HCl. Phản ứng xong thu được 3,36 lít khí (đktc).
a) Viết phương trình hóa học.
b) Tính khối lượng mạt sắt đã tham gia phản ứng.
c) Tính nồng độ mol của dung dịch HCl đã dùng.
• Lời giải:
a) Ta có PTPƯ:
Fe + 2HCl → FeCl2 + H2↑
b) Theo bài ra, ta có: 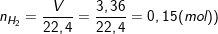
– Theo PTPƯ: nFe = nH2 = 0,15 (mol).
⇒ mFe = n.M = 0,15.56 = 8,4 (g).
c) Theo PTPƯ, ta có: nHCl = 2.nFe = 2.0,15 = 0,3 (mol)
– Mặt khác: VHCl = 50ml = 0,05 (l).
⇒ 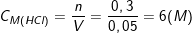
– Vậy nồng độ HCl đã dùng là 6M.
* Bài tập 2: Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Xác định Kim loại R?
Xem lời giải
• Đề bài: Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Xác định Kim loại R?
• Lời giải:
– Theo bài ra ta có: nH2 = V/22,4 = 10,08/22,4 = 0,45(mol).
Gọi hóa trị của kim loại M là a (a chỉ có thể có hóa trị 1, 2, 3, 4)
2R + 2aHCl → 2RCla + aH2↑
2(mol) a(mol)
x?mol ← 0,45(mol)
– Gọi số mol kim loại tham gia phản ứng là x thì 
– Theo bài ra, số gam R bị hòa tan là 25,2 gam
Từ công thức: 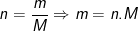 ta có
ta có 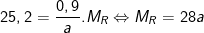
– Thử lần lượt giá trị a = 1,2,3,4 ta thấy chỉ có a = 2 ⇒ MR =28.2 = 56 ≡ Fe là phù hợp.
– Kết luận: Kim loại R là Fe.
* Bài tập 3: Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
Xem lời giải
• Đề bài: Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
• Lời giải:
– Theo bài ra, ta có: nFe = =m/M = 4,48/56 = 0,08 (mol).
– Gọi thể tích dung dịch hỗn hợp axit cần dùng là V (lít)
(Lưu ý là ở cùng điều kiện thì tỉ lệ thể tích cũng là tỉ lệ số mol)
Ta có các phương trình phản ứng sau:
Fe + 2HCl → FeCl2 + H2↑
0,25V ← 0,5V
Fe + H2SO4 → FeSO4 + H2↑
0,75V ← 0,75V
⇒ nFe = 0,25V + 0,75V = 0,08 ⇒ V = 0,08 lít = 80(ml).
– Kết luận: Phải dùng 80ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M để hòa tan 4,48 gam sắt.
* Bài tập Axit tác dụng với Muối
• Khi giải bài tập axit tác dụng với muối cần lưu ý:
– Điều kiện xảy ra phản ứng là sản phẩm phải có chất khí sinh ra, hoặc tạo thành kết tủa.
Axit + Muối → Muối mới + axit mới
Ví dụ: 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
* Bài tập 1: Cho 2,44 gam hỗn hợp muối Na2CO3 và K2CO3 tác dụng vừa đủ với dung dịch H2SO4 0,5M, sau phản ứng thu được 0,448 lít CO2 ở đktc. Tính thể tích dung dịch H2SO4 0,5M cần dùng.
Xem lời giải
• Đề bài: Cho 2,44 gam hỗn hợp muối Na2CO3 và K2CO3 tác dụng vừa đủ với dung dịch H2SO4 0,5M, sau phản ứng thu được 0,448 lít CO2 ở đktc. Tính thể tích dung dịch H2SO4 0,5M cần dùng.
• Lời giải:
– Gọi x,y lần lượt là số mol của Na2CO3 và K2CO3 (với x,y>0)
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O (1)
x mol x mol x mol x mol
K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O (2)
y mol y mol y mol y mol
– Từ PTPƯ ta thấy muối cacbonat tác dụng với H2SO4 thì
nCO2 = nH2O = nH2SO4
mà theo bài ra thì: nCO2 = V/22,4 = 0,448/22,4 = 0,02(mol)
Từ công thức: CM = n/V ⇒ VH2SO4 = n/CM = 0,02/0,5 = 0,04(lit) = 40(ml)
* Bài tập 2: Lấy 200 ml dung dịch BaCl2 0,6M tác dụng với 400 ml dung dịch H2SO4 0,5M thu được m gam kết tủa. Giá trị của m là bao nhiêu?
Xem lời giải
• Đề bài: Lấy 200 ml dung dịch BaCl2 0,6M tác dụng với 400 ml dung dịch H2SO4 0,5M thu được m gam kết tủa. Giá trị của m là bao nhiêu?
• Lời giải:
– Theo bài ra, ta có: VBaCl2 = 200ml = 0,2(lit)
– Từ công thức: CM = n/V ⇒ nBaCl2 = CM.V = 0,6.0,2 = 0,12(mol).
– Ta có PTPƯ:
BaCl2 + H2SO4 → BaSO4 + 2HCl
– Vì 
(Lưu ý: số 1 dưới mẫu tương ứng hệ số của muối và axit trong PTPƯ)
⇒ H2SO4 dư, BaCl2 phản ứng hết ⇒ số mol phản ứng tính theo số mol BaCl2
⇒ Số mol BaSO4 tạo thành: nBaSO4 = nBaCl2 = 0,12(mol).
⇒ Khối lượng BaSO4 là: mBaSO4 = n.M = 0,12.233 = 27,96(g).
Như vậy, với nội dung bài viết về bài tập axit tác dụng với kim loại hay axit tác dụng với muối (điều kiện xảy ra phản ứng axit với muối là sản phẩm phải có chất bay hơi hoặc chất kết tủa) chúng ta thấy rằng cần vận dụng linh hoạt dựa trên tính chất hóa học của các chất và các công thức để giải bài toán.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/bai-tap-axit-tac-dung-voi-kim-loai-axit-tac-dung-voi-muoi-hoa-9-chuyen-de/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





