Bộ đề thi học kì 1 môn Hóa học lớp 8 có đáp án
Đề thi học kì 1 lớp 8 môn Hóa số 1
| PHÒNG GD&ĐT HỮU LŨNG TRƯỜNG THCS MINH HÒA |
ĐỀ KIỂM TRA HKI – NĂM HỌC: 2016 – 2017 Môn: Hóa học – Lớp: 8 Thời gian: 45 phút |
Câu 1 (2,0 điểm)
a) Hãy cho biết thế nào là đơn chất? Hợp chất?
Bạn đang xem bài: ĐỀ THI MÔN HÓA HỌC KÌ 1 LỚP 8
b) Trong số các công thức hóa học sau: CO2, O2, Zn, CaCO3, công thức nào là công thức của đơn chất? Công thức nào là công thức của hợp chất?
Câu 2 (1,0 điểm): Lập công thức hóa học và tính phân tử khối của:
a) Fe (III) và O.
b) Cu (II) và PO4 (III).
Câu 3 (3,0 điểm)
a) Thế nào là phản ứng hóa học? Làm thế nào để biết có phản ứng hóa học xảy ra?
b) Hoàn thành các phương trình hóa học cho các sơ đồ sau:
Al + O2
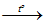
Al2O3
Na3PO4 + CaCl2 → Ca3(PO4)2 + NaCl
Câu 4 (2,0 điểm)
a) Viết công thức tính khối lượng chất, thể tích chất khí (đktc) theo số mol chất.
b) Hãy tính khối lượng và thể tích (đktc) của 0,25 mol khí NO2.
Câu 5 (1,0 điểm): Xác định công thức hóa học của hợp chất tạo bởi 40% S, 60% O. Khối lượng mol của hợp chất là 80 gam.
Câu 6 (1,0 điểm): Khi đốt dây sắt, sắt phản ứng cháy với oxi theo phương trình:
3Fe + 2O2
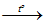
Fe3O4
Tính thể tích khí O2 (đktc) cần dùng để phản ứng hoàn toàn với 16,8 gam Fe.
(Cho: Fe = 56; Cu = 64; P = 31; O = 16; N = 14; O = 16)
ĐÁP ÁN ĐỀ THI HỌC KÌ 1 MÔN HÓA HỌC LỚP 8
Câu 1
- Đơn chất là những chất tạo bởi 1 nguyên tố hóa học.
- Hợp chất là những chất tạo bởi 2 nguyên tố hóa học trở lên.
- Công thức của đơn chất: O2, Zn
- Công thức của hợp chất: CO2, CaCO3.
Câu 2
Fe2O3 = 2.56 + 3.16 = 160 (đvc)
Cu3(PO4)2 = 3.64 + 2(31 + 4.16) = 382 (đvc)
Câu 3
a) Khái niệm phản ứng hóa học: Quá trình biến đổi chất này thành chất khác gọi là phản ứng hóa học.
* Dấu hiệu nhận biết có phản ứng xảy ra: Chất mới tạo thành có tính chất khác với chất ban đầu về trạng thái, màu sắc, … Sự tỏa nhiệt và phát sáng cũng có thể là dấu hiệu của phản ứng.
b) Mỗi phương trình viết đúng: 1,0 điểm
4Al + 3O2
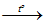
2Al2O3
2Na3PO4 + 3CaCl2 → Ca3(PO4)2 + 6NaCl
Câu 4
a) Viết đúng mỗi công thức tính
- Công thức tính khối lượng khi biết số mol: m = n x M (gam).
- Công thức tính thể tích chất khí (đktc) khi biết số mol: V = n x 22,4 (lít).
b)
mNO2 = 0,25 x 46 = 11,5 gam.
VNO2 = 0,25 x 22,4 = 5,6 lít.
Câu 5
- Khối lượng mỗi nguyên tố trong 1 mol hợp chất:
nS = (40% x 80)/100% = 32 gam; nO = 80 – 32 = 48 gam
- Số mol nguyên tử từng nguyên tố có trong 1 mol hợp chất:
nS = 32 : 32 = 1 mol; nO = 48 : 16 = 3 mol
- CTHH của hợp chất: SO3
Câu 6
nFe = 16,8 : 56 = 0,3 mol
Theo PTHH: 3 mol Fe phản ứng hết với 2 mol O2
Vậy: 0,3 mol Fe phản ứng hết với x mol O2
x = 0,2 mol
VO2 = 0,2 x 22,4 = 4,48 lít
Đề thi học kì 1 lớp 8 môn Hóa số 2
| PHÒNG GD&ĐT CHÂU THÀNH TRƯỜNG THCS THÁI BÌNH |
ĐỀ KIỂM TRA HỌC KỲ I – NH 2016 – 2017 Môn: HÓA HỌC 8 Thời gian 45 phút |
I. Lí thuyết: (5,0 điểm)
Câu 1: (1,0 điểm) Nêu khái niệm nguyên tử là gì? Nguyên tử có cấu tạo như thế nào?
Câu 2: (1,0 điểm) Nêu khái niệm đơn chất là gì? Hợp chất là gì? Cho ví dụ minh họa?
Câu 3: (1,0 điểm) Công thức hóa học CuSO4 cho ta biết ý nghĩa gì? (Biết Cu = 64; S = 32; O = 16)
Câu 4: (1,0 điểm)
a. Khi cho một mẩu vôi sống (có tên là canxi oxit) vào nước, thấy nước nóng lên, thậm chí có thể sôi lên sùng sục, mẩu vôi sống tan ra. Hỏi có phản ứng hóa học xảy ra không? Vì sao?
b. Viết phương trình hóa học bằng chữ cho phản ứng tôi vôi, biết vôi tôi tạo thành có tên là canxi hiđroxit
Câu 5: (1,0 điểm) Nêu khái niệm thể tích mol của chất khí? Cho biết thể tích mol của các chất khí ở đktc?
II. Bài tập: (5,0 điểm)
Câu 6: (2,0 điểm) Cho sơ đồ của các phản ứng sau:
a. Na + O2 – – — > Na2O
b. KClO3 – – – – > KCl + O2 ↑
Hãy viết thành phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phương trình hóa học lập được
Câu 7: (1,0 điểm) Để chế tạo mỗi quả pháo bông nhằm phục vụ cho các chiến sĩ biên phòng giữ gìn biên giới hải đảo ở Quần đảo Trường sa đón xuân về, người ta cho vào hết 600 gam kim loại Magie (Mg), khi pháo cháy trong khí oxi (O2) sinh ra 1000 gam Magie oxit (MgO)
a. Viết công thức về khối lượng của phản ứng?
b. Tính khối lượng khí oxi (O2) tham gia phản ứng?
Câu 8: (2,0 điểm) Hợp chất A có tỉ khối so với khí oxi là 2.
a. Tính khối lượng mol của hợp chất?
b. Hãy cho biết 5,6 lít khí A (ở đktc) có khối lượng là bao nhiêu gam?
ĐÁP ÁN ĐỀ THI HỌC KÌ 1 MÔN HÓA HỌC LỚP 8
Nội dung
Câu 1
– Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện.
– Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm.
Câu 2
– Đơn chất là những chất tạo nên từ một nguyên tố hóa học
Ví dụ: Cu; H2
– Hợp chất là những chất tạo nên từ hai nguyên tố hóa học trở lên
Ví dụ: H2O; H2SO4
Câu 3
– Công thức hóa học CuSO4 cho ta biết:
– Nguyên tố Cu; S; O tạo nên chất
– Trong hợp chất có 1Cu; 1S; 4O
– Phân tử khối: 64 + 32 + 16.4 = 160(đvC)
Câu 4
a. Có xảy ra phản ứng hóa học vì miếng vôi sống tan, phản ứng tỏa nhiệt nhiều làm nước sôi.
b. Phương trình chữ: Canxi oxit + nước → Canxi hiđroxit
Câu 5
– Thể tích mol của chất khí là thể tích chiếm bởi N phân tử chất đó.
– Ở đktc, thể tích mol của các chất khí đều bằng 22,4 lít
II. Bài tập
Câu 6
a. 4Na + O2
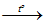
2Na2O
Có tỉ lệ: Số nguyên tử Na: Số phân tử O2: Số phân tử Na2O = 4 : 1 : 2
b. 2KClO3
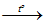
2KCl + 3O2
Có tỉ lệ: Số phân tử KClO3: Số phân tử KCl: Số phân tử O2 = 2 : 2 : 3
Câu 7
a) Áp dụng theo ĐLBTKL, ta có công thức về khối lượng của phản ứng
mMg + mO2 = mMgO
b) Khối lượng khí oxi tham gia phản ứng:
=> mO2 = mMgO – mMg
= 1000 – 600
= 400 (gam)
Câu 8
a) Khối lượng mol của hợp chất A là:
MA = dA/O2.MO2
= 2 . 32 = 64 (gam)
b) Số mol của hợp chất A là:
nA = V/22,4 = 5,6/22,4 = 0,25 (mol)
Khối lượng của 5,6 lít khí A (ở đktc) là:
mA = n.MA
= 0,25 . 64
= 16 (gam)
Đề kiểm tra học kì I lớp 8 môn Hóa học – Đề 2
Đề số 2 (Thời gian làm bài: 45 phút)
I. Trắc nghiệm khách quan (4 điểm)
Hãy khoanh tròn một trong các chữ A, B, C, D trước phương án chọn đúng.
Câu 1. Hãy chọn câu phát biểu đúng .
A. Nguyên tử là những hạt vô cùng nhỏ gồm proton mang điện tích dương và các electron mang điện tích âm.
B. Nguyên tử là những hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử tạo bởi các electron mang điện tích âm.
C. Hạt nhân nguyên tử gồm các hạt proton, notron, electron.
D. Trong mỗi nguyên tử số proton bằng số electron cộng với số notron.
Câu 2. Cho các chất có công thức hóa học như sau:
1. O2 5. SO2
2. O3 6. N2
3. CO2 7. H2O
4. Fe2O3
Nhóm chỉ gồm các hợp chất là:
A. 1 , 3 , 5 , 7 B. 2 , 4 , 6 , 5
C. 2 , 3 , 5 , 6 D. 3 , 4 , 5 , 7
Câu 3. Một bình chứa hỗn hợp khí X gồm 1,12 lit khí oxi và 2,24 lít khí cacbonđioxit ở đktc. Tổng số mol các khí trong hỗn hợp khí X là:
A. 0,25 B. 0,5 C. 0,15 D. 0,20
Câu 4. Công thức hóa học hợp chất của nguyên tố X với nhóm SO4 có hóa trị II là X2(SO4)3. Công thức hóa học hợp chất của nguyên tố Y với hiđro là H3Y.
Công thức hóa học hợp chất của nguyên tố X và nguyên tố Y là:
A . XY2 B. XY3 C. XY D. X2Y3
Câu 5. Đốt cháy hoàn toàn 12,8g đồng (Cu) trong bình chứa oxi (O2) thu được 16 gam đồng (II) oxit (CuO). Khối lượng oxi đã tham gia phản ứng là
A. 6,40 gam B. 4,80 gam.
C. 3,20 gam D. 1,67 gam.
(cho Cu = 64 , O = 16).
Câu 6. Khối lượng của 0,5mol Mg và 0,3mol CO2 tương ứng là
A. 10 gam Mg; 12 gam CO2
B. 13 gam Mg; 15 gam CO2
C. 12 gam Mg; 13,2 gam CO2
D. 14 gam Mg; 14,5 gam CO2
(cho Mg = 24 , O = 16 , C = 12).
Câu 7. Hãy điền các hệ số vào trước công thức hóa học của các chất thích hợp để được các phương trình hóa học đúng.
1. ….. Al + …….H2SO4 → Al2(SO4)3 + ….. H2
2. ….. P + ……. O2 → ….. P2O5
Câu 8. Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
A. 11, 2 lit B. 22,4 lit C. 4,48 lit D. 15,68 lit
II. Tự luận (6 điểm)
Câu 9. (1.5 điểm)
1. Tính khối lượng của một hỗn hợp khí ở đktc gồm 2,24 lit SO2 và 3,36 lit O2
2. Tính thể tích ở đktc của một hỗn hợp khí gồm 4,4 gam CO2 và 3,2 gam O2
3. Tính số mol chứa trong 3.10 23 phân tử nước.
Câu 10. (4,5 điểm)
Phản ứng hóa học xảy ra khi cồn cháy ( đèn cồn trong phòng thí nghiệm) là: Rượu etylic (C2H5OH) + oxi → Cacbonnic (CO2) + Nước
1. Hãy lập phương trình hóa học của phản ứng.
2. Cho biết tỷ lệ số phân tử của các chất trong phản ứng hóa học.
3. Tính tỷ lệ về khối lượng giữa các chất trong phản ứng hóa học.
4. Tính thể tích khí oxi cần thiết để đốt cháy hết 4,6 gam rượu etylic và thể tích khí cacbonic tạo thành ở điều kiện tiêu chuẩn.
(Cho biết: S = 32 ; C = 12 O = 16 ; H = 1)
Đề kiểm tra học kì 1 Hóa học 8
Phần trắc nghiệm 4đ
1. Hãy điền vào chỗ trống những từ hay cụm từ thích hợp sao cho đúng với nội dung các định nghĩa, định luật sau:
a) Một mol của bất kì chất…………. nào ở……………….. điều kiện nhiệt
độ và áp suất đều chiếm những thể tích bằng nhau.
b) Phân tử là…………… đại diện cho chất gồm…………………… liên kết
với nhau và thể hiện đầy đủ tính chất hoá học của chất.
c) Trong một phản ứng hoá học,……………………. của
sản phẩm……………… tổng khối lượng các chất tham gia.
d) Nguyên tố hoá học là tập hợp………………….. có cùng………………
2. Dãy các công thức hoá học nào sau đây viết đúng?
A. H2O, CO3, NaCl, HCl, CaS.
B. H2O, CO2, Al2O, Na2SO4, CaS2.
C. HCl, H2O, CO2, Al2O3, H2SO4.
D. HCl, C02, NaCl2, NaS04,CaS.
3. Khí A nặng hơn khí hiđro 14 lần và là khí độc. Khí A là
A. CO2. B. N2. C.CO. D. SO2.
4. Cho các chất sau:
a) Cát sạch. b) Bột nhôm. c) Muối ăn. d) Vôi sống.
e) Cồn C2H6O. g) Khí hiđro. h) Bột sắt
Nhóm các chất đều gồm các đơn chất ỉà
A.a, b, c. B. b, g, h.
C. b, g, c. D. a, e, b.
Phần tự luận (6đ)
1. (2đ) a) Tính thể tích ở đktc của một hỗn hợp khí gồm 1,1 gam CO2 và 2,8 gam CO.
b) 0,25 mol hợp chất A2O có khối lượng 15,5 gam. Tìm CTHH của hợp chấtế
c) Hợp chất khí NOx có tí khối với hiđro là 23. Tìm CTHH của hợp chất.
2.. (2 điểm) Điền hệ số thích hợp để hoàn thành các phương trình hoá học sau:
Fe + Cu → FeCl3
Al(OH)3 → Al2O3 +H2O.
Ca(OH)2+ H3PO4 → Ca3(PO4)2 + H2O
ZnS + O2 → ZnO + SO2
3. (2đ) Cho 6,5 gam kim loại X hoá trị II tác dụng hoàn toàn vời khí oxi (đktc), sau phản ứng thu được 8,1 gam muối XO. Hỏi:
a) Viết PTHH.
b) Tính thể tích khí oxi (đktc) đã phản ứng với kim loại X.
c) Tìm kim loại X.
(Biết: C = 12 ; N = 14 ; s = 32 ; Na = 23 ; C1 = 35,5 ; Zn = 65 ; O = 16.)
Đề kiểm tra học kì 1 Hóa học 8 – Đáp án
Phần trắc nghiệm (4đ)
Trả lời đúng mỗi câu được 1,0 điểm
1. a) Một mol của bất kì chất khí nào ở cùng điều kiện nhiệt độ và áp suất đều chiếm những thể tích bằng nhau.
b) Phân tử là hạt đại diện cho chất gồm một số nguyên tử liên kết với nhau và thê hiện đầy đủ tính chất hoá học của chất.
c) Trong một phản ứng hoá học, tổng khôi lượng của sản phẩm bằng tổng khối lượng các chất tham gia.
d) Nguyên tố hoá học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân
2. C
3. C Câu 4. B.
Phần tự luận (6đ)
1. (2 điểm)
a) Thể tích của hỗn hợp là
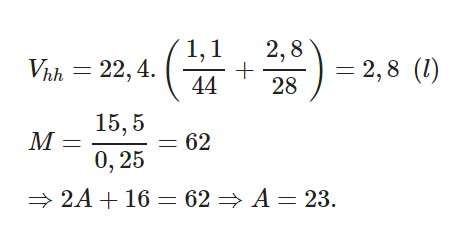
b) Nguyên tố Na ⇒⇒ Na2O
c) M=23.2=46⇒14+16x=46M=23.2=46⇒14+16x=46
⇒x=2⇒NO2

Đề kiểm tra kì 1 lớp 8 môn Hóa 2018 mới nhất có đáp án
Đề thi cuối kì 1 môn Hóa lớp 8 năm học 2018 – 2019 của trường THCS Thái Bình có đáp án chi tiết
PHÒNG GD&ĐT CHÂU THÀNH ĐỀ THI HỌC KÌ I NĂM HỌC 2018 – 2019
TRƯỜNG THCS THÁI BÌNH MÔN : HÓA HỌC 8
Thời gian: 45 phút (Không kể thời gian phát đề)
I.Lí thuyết: (5đ)
Câu 1: (1đ) Nêu khái niệm nguyên tử là gì? Nguyên tử có cấu tạo như thế nào?
Câu 2: (1đ) Nêu khái niệm đơn chất là gì? Hợp chất là gì? Cho ví dụ minh họa?
Câu 3: (1đ) Công thức hóa học CuSO4 cho ta biết ý nghĩa gì?
(Biết Cu = 64 ; S = 32 ; O = 16)
Câu 4: (1 điểm )
1. Khi cho một mẩu vôi sống (có tên là canxi oxit) vào nước, thấy nước nóng lên, thậm chí có thể sôi lên sùng sục, mẩu vôi sống tan ra. Hỏi có phản ứng hóa học xảy ra không? Vì sao?
2. Viết phương trình hóa học bằng chữ cho phản ứng tôi vôi, biết vôi tôi tạo thành có tên là canxi hiđroxit
Câu 5: (1 điểm ) Nêu khái niệm thể tích mol của chất khí? Cho biết thể tích mol của các chất khí ở đktc?
II.Bài tập: (5đ)
Câu 6: (2 điểm ) Cho sơ đồ của các phản ứng sau:
a. Na + O2 – – — > Na2O
b. KClO3 – – – – > KCl + O2↑
Hãy viết thành phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phương trình hóa học lập được
Câu 7: (1 điểm ) Để chế tạo mỗi quả pháo bông nhằm phục vụ cho các chiến sĩ biên phòng giữ gìn biên giới hải đảo ở Quần đảo Trường sa đón xuân về, người ta cho vào hết 600 gam kim loại Magie (Mg), khi pháo cháy trong khí oxi (O2) sinh ra 1000 gam Magie oxit (MgO)
a) Viết công thức về khối lượng của phản ứng?
b) Tính khối lượng khí oxi (O2) tham gia phản ứng?
Câu 8: (2 điểm ) Hợp chất A có tỉ khối so với khí oxi là 2.
a) Tính khối lượng mol của hợp chất?
b) Hãy cho biết 5,6 lít khí A (ở đktc) có khối lượng là bao nhiêu gam?
Đề kiểm tra kì 1 lớp 8 môn Hóa 2018 mới nhất – Đáp án
NĂM HỌC 2018 – 2019
I.Lí thuyết:
Câu 1: – Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện.
– Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm
Câu 2: – Đơn chất là những chất tạo nên từ một nguyên tố hóa học
Ví dụ: Cu; H2
– Hợp chất là những chất tạo nên từ hai nguyên tố hóa học trở lên
Ví dụ: H2O; H2SO4
Câu 3: – Công thức hóa học CuSO4 cho ta biết:
– Nguyên tố Cu; S; O tạo nên chất
– Trong hợp chất có 1Cu; 1S; 4O
– Phân tử khối: 64 + 32 + 16.4 = 160(đvC)
Câu 4: a. Có xảy ra phản ứng hóa học vì miếng vôi sống tan, phản ứng tỏa nhiệt nhiều làm nước sôi.
b. Phương trình chữ: Canxi oxit + nước → Canxi hiđroxit
Câu 5: Thể tích mol của chất khí là thể tích chiếm bởi N phân tử chất đó.
– Ở đktc, thể tích mol của các chất khí đều bằng 22,4 lít
II.Bài tập:
Câu 6:
a. 4Na + O2 →t0 2Na2O
Có tỉ lệ: Số nguyên tử Na: Số phân tử O2: Số phân tử Na2O
= 4 : 1 : 2
b. 2KClO3 →t0 2KCl + 3O2↑
Có tỉ lệ: Số phân tử KClO3: Số phân tử KCl: Số phân tử O2
= 2 : 2 : 3
Câu 7:
a) Áp dụng theo ĐLBTKL, ta có công thức về khối lượng của phản ứng
mMg + mO2 = mMgO
b) Khối lượng khí oxi tham gia phản ứng:
=> mO2 = mMgO – mMg
= 1000 – 600
= 400 (gam)
Câu 8:
a) Khối lượng mol của hợp chất A là:
MA = dA/O2 . MO2
= 2 . 32 = 64 (gam)
b) Số mol của hợp chất A là:
nA = V/22,4 = 5,6/22,4 = 0,25 (mol)
Khối lượng của 5,6 lít khí A (ở đktc) là:
mA = n.MA = 0,25 . 64 = 16 (gam)
Đề kiểm tra kì 1 Hóa 8 có đáp án
Cùng thử sức với đề thi học kì 1 môn Hóa lớp 8 – THCS Trần Văn Thới. Đề có 2 phần trắc nghiệm và tự luận cụ thể như sau:
KIỂM TRA HỌC KÌ I
Môn : Hóa 8
Thời gian: 45 Phút
I. TRẮC NGHIỆM (3 điểm)
Hãy chọn đáp án đúng ghi vào bài làm
Câu 1: Thành phần cấu tạo của nguyên tử gồm các loại hạt là
A. proton, nơtron B. proton, electron
C. proton, nơtron, electron D. nơtron, electron
Câu 2 Dãy chất nào sau đây chỉ gồm công thức hóa học của các hợp chất:
A. CaCO3, NaOH, Fe B. FeCO3, NaCl, H2SO4
C. NaCl, H2O, H2 D. HCl, NaCl, O2
Câu 3. Hóa trị của lưu huỳnh trong công thức SO2 là :
A. II B. VI C. III D. IV
Câu 4. Phương trình phản ứng hóa học được viết đúng là

II.TỰ LUẬN (7 điểm)
Bài1. (2 đ) Nêu định luật bảo toàn khối lượng.Viết biểu thức tổng quát.
Bài 2. (2 đ).Lập phương trình hóa học cho các sơ đồ sau?
a) Al + HCl —- > AlCl3 + H2.
b). Na + H2O—- > NaOH + H2
Bài 3. ((3,0 đ):. . Tìm số mol các chất sau :
a, 32 g O2 ,
b. 17,4 g K2SO4 ,
c. 5,6 lít khí CO2 ( đktc)
Cho: H = 1; C = 12 ; O = 16 ; S = 32; K = 39;.
——————— Hết———————-
Đề kiểm tra kì 1 Hóa 8 ĐÁP ÁN – BIỂU ĐIỂM
Phần I: Trắc nghiệm khách quan (3 điểm)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | C | B | D | C | B | A |
| Điểm | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
Phần II: Tự luận (7 điểm

Kiểm tra Hóa 8 học kì 1
PHÒNG GD & ĐT HÀ ĐÔNG – TRƯỜNG THCS LÊ LỢI
ĐỀ KIỂM TRA HỌC KỲ I (2017-2018)
MÔN: HÓA HỌC – LỚP 8
Thời gian làm bài : 45 phút
I. TRẮC NGHIỆM ( 3 điểm):
Hãy khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1. Hạt nhân nguyên tử cấu tạo bởi:
A. Proton và electron
B. Proton và nơtron
C. Nơtron và electron
D. Proton, nơtron và electron.
Câu 2. Dãy chất gồm các đơn chất:
A. Na, Ca, CuCl2, Br2.
B. Na, Ca, CO, Cl2
C. Cl2, O2, Br2, N2.
Câu 3. Công thức hoá học của hợp chất tạo bởi nguyên tố R với nhóm SO4 là R2(SO4)3. Công thức hoá học của hợp chất tạo bởi nguyên tố R và nguyên tố O là:
A. RO B. R2O3 C. RO2 D. RO3
Câu 4. Chất khí A có công thức hoá học của A là:
A. SO2 B. CO2 C. NH3 D. N2
Câu 5. Số phân tử của 16 gam khí oxi là:
A. 3. 1023 B. 6. 1023 C. 9. 1023 D. 12.1023
Câu 6. Đôt cháy hết một phân tử hợp chất A( chưa biết) cần 2 phân tử O2 . Sau phản ứng thu được 2 phân tử CO2 và 2 phân tử H2O. Công thức hoá học của hợp chất A là:
A. C2H6 B. C2H4 C. C2H4O D. C2H4O2
PHẦN TỰ LUẬN (7 điểm):
1. Hoàn thành các phương trình hoá học sau:
- Na + O2 t0 → Na2O
- Na3PO4 + BaCl2 → NaCl + Ba3(PO4)2
- Al2O3 + H2SO4 → Al2(SO4)3 + H2O
( Cân bằng luôn vào các phản ứng phía trên, không cần viết lại)
2:Cho a gam nhôm (Al) tác dụng vừa đủ với dung dịch chứa 29,4 gam axit sunfuric ( H2SO4 ). Sau phản ứng thu được muối nhôm sunfat (Al2(SO4)3 ) và khí hiđro ( H2)
- Viết phương trình hóa học?
- Tính a gam nhôm đã tham gia phản ứng?
- Tính thể tích khí hiđro sinh ra ( ở đktc)?
3: Hợp chất A chứa nguyên tố: Fe và O . Trong phân tử A có 7 nguyên tử và MA=232 (g/mol). Tìm công thức hoá học của A?
(Cho biết : S =32 ; O =16; Al=27; H=1; Fe=56; C=12)
Kiểm tra Hóa 8 học kì 1 Đáp án
I.TRẮC NGHIỆM
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | B | C | B | D | A | D |
II. PHẦN TỰ LUẬN
1. : HS tự giải
2. ( 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Tính được khối lượng a gam nhôm: 5,4( gam)
Tính được thể tích khí H2 sinh ra (đktc): 6,72 ( lít)
3. Xác định được công thức hoá học của hợp chất A: Fe3O4
Đề kiểm tra 1 tiết học kì 1 môn Hóa 8
Đề thi, kiểm tra hóa 8 của Phòng GD&ĐT Tĩnh Gia – Thanh Hóa năm 2017-2018.
Câu 1:(2điểm)
- Phản ứng hóa học là gì ?
- Viết công thức về khối lượng cho phản ứng chất A tác dụng với chất B tạo ra chất C
- Hãy phát biểu quy tắc hóa trị của hợp chất gồm hai nguyên tố.
Câu 2: (2điểm)
- Lập công thức hóa học của hợp chất gồm hai nguyên tố C (IV) và O
- Mỗi cách viết 2S; 3O2 ; HCl ; Al lần lượt có ý nghĩa gì
Câu 3:(1điểm)
Lập phương trình hóa học của phản ứng sau
- Cu + O2 → CuO
- Al2O3 + HCl → AlCl3 + H2O
Câu 4:( 2điểm)
- Tính thể tích (đktc) của 22 gam khí CO2
- Trong 2 mol phân tử Fe2O3có bao nhiêu gam nguyên tử nguyên tố Fe
Câu 5:(3 điểm)
Cho khí hyddro dư đi qua đồng (II) o xít ( CuO) nóng đen, người ta thu được 3,2 g kim loại đồng màu đỏ và hơi nước (H2O) ngưng tụ
- Viết phương trình hóa học xảy ra
- Tính khói lượng đồng (II) o xít tyham gia phản ứng
- Tính thể tích khí hyđro ở đktc đã tham gia phản ứng
( cho Cu = 64; O 16 ; h =1)
Đề kiểm tra 1 tiết học kì 1 môn Hóa 8 Lời giải và hướng dẫn
1. a.Phản ứng hóa học là quá trình biến đổi chất này thành chất khác.
b. Công thức về khối lượng: mA + mB = mC
c. Trong công thức hóc học, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
2. Viết công thức dạng chung: CxOy
– Theo quy tắc hóa trị: x x IV = y xII
– Chuyển thành tỉ lệ: x/y = II/IV = ½ → x = 1, y = 2
– Công thức hóa học là: CO2
b. Cách viết: 2 S chỉ 2 nguyên tử S
3 O2 chỉ 3 phân tử O2
HCl chỉ 1 phân tử HCl
Al chỉ 1 nguyên tử Al
3. a.2 Cu + O2 → 2 CuO
b.Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
4. a. Số mol khí CO2 : n= 22/44 = 0,5 (mol)
– Thể tích khí CO2 ở đktc là: V = n x 22,4= 0,5 x 22,4= 11,2 (l)
b.Trong 2 mol phân tử Fe2O3 có 2 x 2 = 4 mol nguyên tử Fe.
– Khối lượng 4 mol nguyên tử Fe là: 4 x 56 = 224 (g)
5. a. Phương trình hóa học:
CuO + H2 →Cu + H2O
b. Số mol Cu thu được sau phản ứng: n= 3,2/64 = 0,05 (mol)
Theo PTHH: nCuO = nCu=0,05 (mol)
Khối lượng đồng (II) oxit tham gia phản ứng:
mCuO = nCuO x MCuO = 0,05 x 80 = 4 (g)
c. Theo PTHH: nH2 = nCuO=0,05 (mol)
Thể tích khí hiđro ở đktc đã tham gia phản ứng là:
VH2 = nH2 x 22,4 = 0,05 x 22,4 = 1,12 (l)
Giới thiệu 2 đề kiểm tra kì 1 Hóa lớp 8 có đáp án – THCS Thái Bình + Ngô Mây 2017
PHÒNG GD & ĐT CƯM’GAR
TRƯỜNG THCS NGÔ MÂY
ĐỀ THI HỌC KÌ 1
Môn : Hoá học 8
I) Trắc nghiệm : ( 3 điểm) Khoanh tròn vào ý đúng trong câu sau :
Câu 1: Hiện tượng hoá học khác với hiện tượng vật lý là :
a) Chỉ biến đổi về trạng thái.
b) Có sinh ra chất mới.
c) Biến đổi về hình dạng.
d) Khối lượng thay đổi.
Câu 2: Trong 1 phản ứng hoá học các chất phản ứng và sản phẩm chứa cùng:
a) Số nguyên tử của mỗi nguyên tố. b) Số phân tử trong mỗi chất.
c) Số phân tử của mỗi chất. d) Số nguyên tố tạo ra chất.
Câu 3: Hạt mang điện dương là:
a). Nguyên tử b). proton
c). electron d). Nơtron
Câu 4: Phân tử khối của hợp chất CO là:
a) 18 đvC b) 28 đvC c) 44 đvC d) 56 đvC
Câu 5: Trong hợp chất AxBy . Hoá trị của A là a, hoá trị của B là b thì quy tắc hóa trị là:
a) a.b = x.y b) a.y = b.x
c) a.A= b.B d) a.x = b.y
Câu 6: Đốt cháy 3,2g Lưu huỳnh trong oxi sau phản ứng thu được 5,6g Lưu huỳnh trioxit. Khối lượng oxi tham gia là :
a). 2,4g b) . 8,8g c). 24g d. không tính được
II) Tự luận : ( 7 điểm)
Câu 1: (4 điểm) Lập phương trình hóa học cho các phản ứng sau:

Câu 2 : (3 điểm) Cho 5,4 gam nhôm tác dụng vừa đủ với khí oxi thu được nhôm oxit theo phương trình hóa học sau:
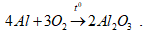
a. Tính khối lượng nhôm oxit(Al2O3) tạo thành.
b. Tính thể tích khí oxi(đktc) tham gia phản ứng.
(Cho nguyên tử khối: C=12, O=16, Al=27)
Giới thiệu 2 đề kiểm tra kì 1 Hóa lớp 8 có đáp án – THCS Thái Bình + Ngô Mây 2017 ĐÁP ÁN
I) Trắc nghiệm( 3 điểm): Mỗi câu đúng 0,5 điểm
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 | Câu 6 |
| b | a | b | b | d | a |
II) Tự luận : ( 7 điểm) :

PHÒNG GD&ĐT CHÂU THÀNH
TRƯỜNG THCS THÁI BÌNH
ĐỀ THI HỌC KÌ 1 NĂM HỌC 2017 – 2018
MÔN : HÓA HỌC 8
Thời gian: 45 phút (Không kể thời gian phát đề)
I. Lí thuyết: (5 điểm)
Câu 1: (1 điểm ) Nêu khái niệm phân tử là gì? Cho ví dụ?
Câu 2: (1 điểm ) Hóa trị của một nguyên tố (hay nhóm nguyên tử) là gì? Hóa trị được xác định như thế nào?
Câu 3: (1 điểm) Công thức hóa học H3PO4 cho ta biết ý nghĩa gì?
(Biết H = 1 ; P = 31 ; O = 16)
Câu 4: (1 điểm ) Trong xây dựng người ta dùng nước vôi (có chất Canxi hiđroxit) được quét lên tường nhà một thời gian sau đó sẽ khô và hóa rắn (chất này là Canxi cacbonat).
a. Dấu hiệu nào cho thấy đã có phản ứng hóa học xảy ra?
b. Viết phương trình chữ của phản ứng, biết rằng có chất khí cacbon đioxit (chất này có trong không khí) tham gia và sản phẩm ngoài chất rắn còn có nước (chất này bị bay hơi)
Câu 5: (1 điểm ) Nêu khái niệm mol? Cho ví dụ minh họa?
II. Bài tập: (5 điểm)
Câu 6: (2 điểm ) Cho sơ đồ của các phản ứng sau:
a. Al + O2 – – — > Al2O3
b. KMnO4 – – – – > K2MnO4 + MnO2 + O2 ↑
Hãy viết thành phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phương trình hóa học lập được.
Câu 7: (1 điểm ) Để chế tạo mỗi quả pháo bông nhằm phục vụ cho các chiến sĩ biên phòng giữ gìn biên giới hải đảo ở Quần đảo Trường sa đón xuân về, người ta cho vào hết 600 gam kim loại Magie (Mg), khi pháo cháy trong khí oxi (O2) sinh ra 1000 gam Magie oxit (MgO)
a) Viết công thức về khối lượng của phản ứng?
b) Tính khối lượng khí oxi (O2) tham gia phản ứng?
Câu 8: (2 điểm ) Hợp chất A có tỉ khối so với khí hiđro là 17.
a. Tính khối lượng mol của hợp chất
b. Hãy cho biết 5,6 lít khí A (ở đktc) có khối lượng là bao nhiêu gam?
____ HẾT ____
ĐÁP ÁN ĐỀ THI MÔN HÓA HỌC 8 HK I
NĂM HỌC 2017 – 2018

Tuyển chọn 2 đề thi Hóa lớp 8 học kì 1 có đáp án
ĐỀ KIỂM TRA CHẤT LƯỢNG HỌC KÌ 1
MÔN: HÓA – LỚP 8
I. Phần trắc nghiệm:(3 điểm)
*Hãy khoanh tròn vào chữ cái đứng trước cho câu trả lời đúng (mỗi câu đúng 0,5đ):
Câu 1:Trong các dãy chất sau dãy nào toàn là đơn chất?
A. H2, O2,Na. B. CaO, CO2,ZnO.
C. H2NO3,H2CO3,H2SO4. D. Na2SO4.,K2SO4, CaCO3.
Câu 2:Trong các dãy chất sau dãy nào toàn là hợp chất?
A. C, H2, Cl2, CO2. B. H2, O2, Al , Zn;
C. CO2,CaO,,H2O; D. Br2, HNO3,NH3.
Câu3: Biết Al có hóa trị (III) và O có hóa trị (II) nhôm oxit có công thức hóa học là:
A. Al2O3 B. Al3O2 C. AlO3 D. Al2O
Câu4: Quá trình nào sau đây là xảy hiện tượng hóa học:
A. Muối ăn hòa vào nước.
B.Đường cháy thành than và nước
.Cồn bay hơi D. Nước dạng rắn sang lỏng
Câu 5: Công thức náo tính thể tích khí ở (đktc);
A. m = n x M .
B.
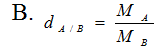
C. V = n x 22,4l
Câu 6: Phân tử khối của hợp chất CaCO3 là:
A. 70 g/mol B. 80 g/mol C. 90 g/mol D.100 g/mol
II. Phần tự luận: :(7điểm)
Câu 1: (3điểm) -Hoàn thành phương trình hóa hoc và cho biết tỉ lệ của các chất trong phản ứng sau:
a. Na + O2 — > Na2 b. CaCO3 — > CaO + CO2.
c. Mg + Fe2 (SO4 )3 –> MgSO4 + Fe
Câu 2: (2điểm) -Đốt cháy hoàn toàn 6 gam Magie (Mg) trong oxi thu được Magie oxit (MgO).
Tính khối lượng cuar Magie oxit (MgO) thu được?
Câu 3: (2điểm) Một hợp chất A có khối lượng mol phân tử là 100g/mol.biết về thành phần các nguyên tố theo khối lượng: 40%Ca; 12%C và còn lai là O. Hãy xác định công thức hóa học của hợp chất của A.
Cho biết nguyên tử khối: (Ca=40; O=16; C=12; Mg=24 )
——- HẾT ——-
Đáp Án
I. phần trắc nghiệm:(3điểm)
| 1A | 2C | 3A | 4B | 5C | 6D |
II. phần tự luận: :(7điểm)
| Câu 1: (3điểm) | Cân bằng đúng và tỉ lệ của mỗi chất (1 điểm) | 2 |
| Câu 2: (2điểm) | -nMg = 6 : 24 = 0,25 mol2Mg + O2 → 2MgO2mol 2mol0,25mol 0,25mol→ nMgO = 0,25mol → mMgO = nMgO . mMgO= 0.25 . 40 = 10 g | 0,250,251,5 |
| Câu 3; (2điểm) | Công thức hợp chất của A là: CaCO3 | 2 |
Đề Số 2
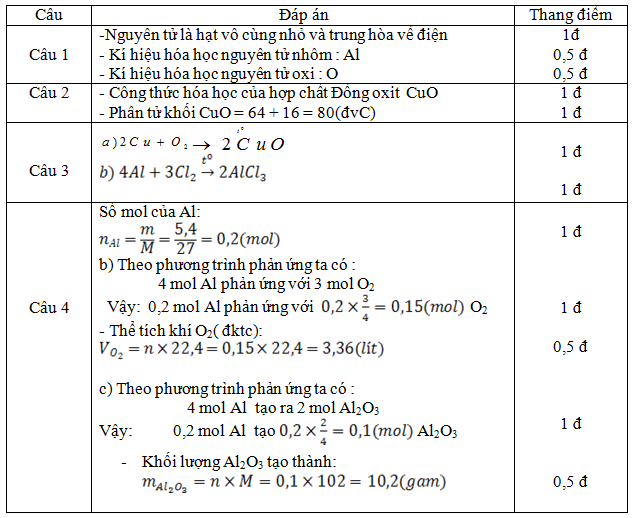
Câu 1: (2đ) Nêu khái niệm về nguyên tử , Viết kí hiệu hóa học của nguyên tử nhôm , và nguyên tử Oxi .
Câu 2 : ( 2đ )Viết công thức hóa học và tính phân tử khối của hợp chất Đồng oxit. Biết trong phân tử có 1 nguyên tử Cu và 1 nguyên tử O .
Câu 3: (2đ) Chọn hệ số thích hợp đặt vào chỗ có dấu chấm hỏi trong các phương trình hóa học sau :

Câu 4 : (4đ) Cho 5,4 gam kim loại nhôm phản ứng vừa đủ với khí oxi tạo thành nhôm oxit theo phản ứng :
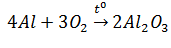
Hãy tính :
a) Thể tích khí oxi (đktc) cần ung cho phản ứng trên .
b) Khối lượng Al2O3 tạo thành trong phản ứng trên.
(Cho biết nguyên tử khối các nguyên tố: Al=27; O=16; Cu=64; H=1)
–Hết–
ĐÁP ÁN VÀ THANG ĐIỂM
Đề thi Hóa kì 1 lớp 8 tuyển chọn hay nhất 2017
ĐỀ KIỂM TRA HỌC KỲ I NĂM HỌC 2017-2018
Môn: Hóa học – Lớp 8
Thời gian làm bài: 45 phút (không kể thời gian giao đề)
I. Trắc nghiệm (2,0 đ). Chọn đáp án đúng nhất trong các phương án trả lời sau.
Câu 1. Các nguyên tử của cùng một nguyên tố hóa học có cùng:
| A. Số proton trong hạt nhân. | B. Số nơtron |
| C. Số điện tử trong hạt nhân | D. Khối lượng |
Câu 2. Hiện tượng nào sau đây là hiện tượng hóa học?
A. Nhôm nung nóng chảy để đúc xoong, nồi…
B. Than cần đập vừa nhỏ trước khi đưa vào bếp lò.
C. Cồn để trong lọ không kín bị bay hơi.
D. Trứng để lâu ngày sẽ bị thối.
Câu 3. Trong công thức hóa học của hiđrô sunfua (H2S) và khí sunfurơ (SO2), hóa trị của lưu huỳnh lần lượt là:
| A. I và II | B. II và IV | C. II và VI. | D. IV và VI |
Câu 4. Hỗn hợp khí gồm khí O2 và khí CO2 có tỉ khối đối với khí Hiđrô là 19, thành phần % các khí trong hỗn hợp lần lượt là:
| A. 60%; 40% | B. 25%; 75% | C. 50%; 50% | D. 70%; 30% |
II. Tự luận (8,0 đ).
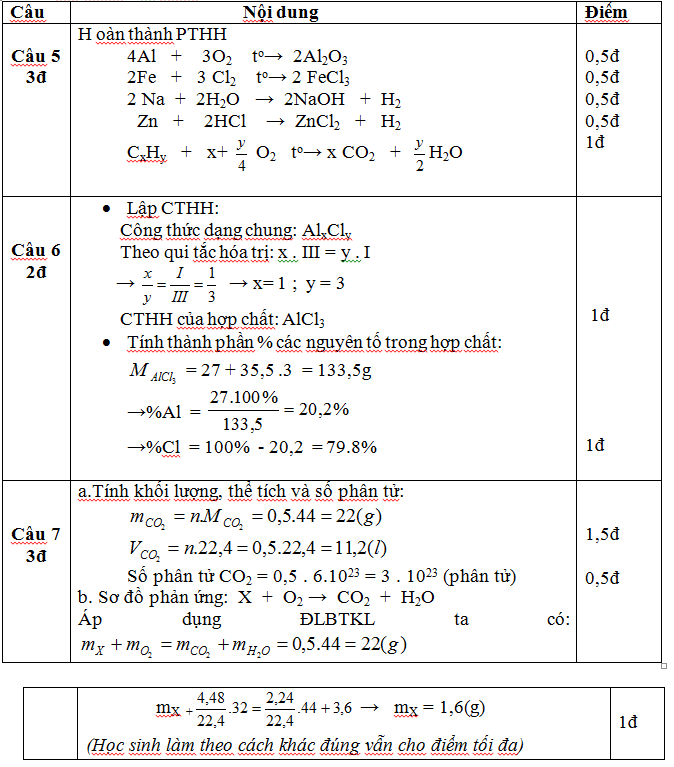
Câu 5. Hoàn thành các phương trình hóa học sau:
? + O2 → Al2O3
Fe + ? → FeCl3
Na + H2O → NaOH + H2
? + HCl → ZnCl2 + H2
CxHy + O2 → CO2 + H2O
Câu 6. Lập công thức hóa học của hợp chất gồm Al(III) liên kết với Cl(I). Tính thành phần phần trăm theo khối lượng các nguyên tố trong hợp chất đó?
Câu 7.
a) Tính khối lượng, thể tích (ở đktc) và số phân tử CO2 có trong 0,5 mol khí CO2?
b) Đốt cháy hoàn toàn m gam chất X cần dùng 4,48 lít khí O2(đktc) thu được 2,24 lít CO2(đktc) và 3,6 gam H2 Viết sơ đồ phản ứng và tính khối lượng chất ban đầu đem đốt?
(Cho biết: C = 12, O = 16, S = 32, H = 1, Al = 27, Cl = 35,5)
——— HẾT ———
| PHÒNG GD&ĐT | HƯỚNG DẪN CHẤM THI HỌC KỲ 1NĂM HỌC 2016-2017Môn: Hóa học – Lớp 8 |
I. Trắc nghiệm (2,0 điểm).
Mỗi câu trả lời đúng được 0,5 điểm
| Câu | 1 | 2 | 3 | 4 |
| Đáp án | A | D | B | C |
II. Tự luận (8,0 điểm).
Đáp án và đề kiểm tra cuối học kì 1 lớp 8 môn Hóa năm 2017
| SỞ GIÁO DỤC VÀ ĐÀO TẠOTRƯỜNG …………… | ĐỀ KIỂM TRA CUỐI HỌC KỲ I (2017 – 2018)Môn Hóa học 8Thời gian làm bài: 45 phút; |
I. PHẦN TRẮC NGHIỆM : (3 Điểm)
Câu 1: Số e trong nguyên tử Al (có số proton =13), là:
a) 10 b) 11 c) 12 d) 13.
Câu 2: Số e lớp ngoài cùng của nguyên tử Al (có số proton =13) là:
a) 1 b) 2 c) 3 d) 4.
Câu 3: Số lớp e của nguyên tử Al (có số proton =13) là:
a) 1 b) 2 c) 3 d)
Câu 4: Khối lượng của 1 nguyên tử Cacbon là:
a) 1,9926.10-23g b) 1,9926g
c) 1,9926.10-23đvc d) 1,9926đvC.
Câu 5: Khối lượng của 1 đvC là:
a) 1,6605.10-23g b) 1,6605.10-24g
c) 6.1023g d) 1,9926.10-23g
Câu 6: Hiện tượng hoá học khác với hiện tượng vật lý là :
a) Chỉ biến đổi về trạng thái.
b) Có sinh ra chất mới.
c) Biến đổi về hình dạng.
d) Khối lượng thay đổi.
Câu 7 : Trong quá trình phản ứng, lượng chất phản ứng :
a) Giữ nguyên . b) Tăng c) Giảm dần d) Cả a,b,c.
Câu 8 : Trong 1 phản ứng hoá học các chất phản ứng và sản phẩm chứa cùng:
a) Số nguyên tử của mỗi nguyên tố. b) Số phân tử trong mỗi chất.
c) Số phân tử của mỗi chất. d) Số nguyên tố tạo ra chất.
Câu 9: Tỉ lệ % khối lượng của các nguyên tố Ca, C, O trong CaCO3 lần lượt là:
a) 40%; 40%; 20% b) 20% ; 40% ; 40%
c) 40%; 12%; 48% d)10% ; 80% ; 10%
Câu 10: Trong hợp chất AxBy . Hoá trị của A là m, hoá trị của B là n thì quy tắc hóa trị là:
a) m.n = x.y b) m.y = n.x
c) m.A= n.B d) m.x = n.y
B. PHẦN TỰ LUẬN : (7 Điểm)
Bài 11(2đ): Phát biểu nội dung định luật bảo toàn khối lượng.
Áp dụng : Nung 10,2g đá vôi (CaCO3) sinh ra 9g vôi sống và khí cacboníc
a. Viết công thức về khối lượng.
b. Tính khối lượng khí cacboníc sinh ra.
Bài 12(2đ): Lập phương trình hóa học của các phản ứng sau:
a. Nhôm + Khí —-t°—> ôxi Nhôm ôxit.
b. Natri + Nước —–> Natri hiđrôxit + Khí Hiđrô
Bài 13(3đ): Cho 13 gam Kẽm tác dụng vừa đủ với axit clohiđric theo phương trình
Zn + HCl —–> ZnCl2 + H2
a) Tính số mol Zn và lập phương trình phản ứng trên.
b) Tính thể tích khí H2 thoát ra (đktc).
c) Tính khối lượng axit clohiđric (HCl) đã dùng cho phản ứng trên.
(Cho KLNT: Ca = 40; C = 12; O = 16; Zn = 65; H = 1; Cl = 35,5)
(Hóa trị: Al(III); O(II); Na(I); H(I).
Đáp Án Đề thi HKI HÓA 8 2017 – 2018
A . TRẮC NGHIỆM KHÁCH QUAN(3 Điểm)
Chọn và khoanh tròn vào chữ cái có phương án trả lời đúng nhất. Mỗi câu trả lời đúng 0.3đ
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | d | c | c | a | b | b | a | d | c | d |

Nội dung ôn thi học kì 1 môn Hóa lớp 8 rất hay năm 2016
CÂU HỎI ÔN TẬP HỌC KÌ 1
MÔN: HÓA HỌC – LỚP 8
1. Lập CTHH và tính PTK của hợp chất tạo bởi:
a,Fe (III) và Cl b, K và CO3 c,S(VI) và O d, C(IV) và O
2. Tính hóa trị của các ng tố trong các hợp chất :
a,MgSO4 b,Fe(OH)2 c, SO2 d, ZnCl2
3. Hãy nêu những gì biết được về muối Kali nitrat có CTHH là KNO3
4. Các cách viết sau chỉ ý gì?
a,3H2O b,3H2 c,2H d,N2
5. Cho biết ng tố R có hóa trị II và III.Hãy chọn CTHH đúng : RO,RO3,R2H,RH3
6.Một ng tố X có hóa trị II lien kết với nhóm OH tạo thành hợp chất có PTK là 90đvC
a,X là ng tố nào? KHHH của X?
b,tính khối lượng gam của 2 ng tử X
c,so sánh xem X nặng hay nhẹ hơn O bao nhiêu lần?
d,lập CTHH của hợp chất tạo bởi X và SO4
7. Dùng chữ số và KHHH hoặc CTHH để diễn đạt các ý sau:
– Ba phân tử clo -hai ng tử bạc
-bốn ng tử magie
– năm phân tử oxi
-ba phân tử đá vôi (1Ca,1C,3 O)
8.Lập CTHH và tính PTK của hợp chất tạo bởi:
a,Fe (II) và NO3 b, Ca và SO3
d, Na và SO4 c, Mg và Cl
9. Tính hóa trị của các ng tố trong các hợp chất :
a,CuSO4 b,Pb(OH)2 c, NO2 d, BaCl2
10. Cho CTHH hợp chất của ng tố X với O là XO2,và hợp chất của ng tố Y với H là YH.Hãy xác định CTHH của hợp chất X với Y
11. 1 hợp chất có phân tử gồm 1 ng tử ng tố X liên kết với 3 ng tử oxi và nặng gấp 2,5 lần phân tử oxi.Hãy cho biết:
a, PTK của hợp chất
b,X là ng tố nào? KHHH của X?
c,tính khối lượng gam của 2 ng tử X
d,so sánh xem X nặng hay nhẹ hơn N bn lần?
12.chỉ ra CTHH sai và sửa lại cho đúng :Al2O3,
CaO,Na2O,HSO4, AlCl2 ,CuO ,ZnSO4
13. Cho sơ đồ phản ứng: Mg(OH)2+ HCl → MgxCly + H2O
a) Xác định các chỉ số x,y.
b) Lập phương trình hóa học
c) Cho biết tỉ lệ của 2 cặp chất trong phản ứng
14. Hãy cho biết 67, 2 lít khí O2 (đo ở đktc) có
a. Bao nhiêu mol O2?
b. Bao nhiêu khối lượng gam O2?
15. Cho sắt Fe tác dụng với 6,72 lít khí clo Cl2 (đo ở đktc) tạo thành 32,5 gam sắt (III) clorua FeCl3.
a/ Lập phương trình hóa học.
b/ Viết công thức về khối lượng của phản ứng xảy ra.
c/ Tính khối lượng sắt đã phản ứng.
16. Lập CTHH và tính PTK của hợp chất tạo bởi:
a,NH4 và SO3 b, Ca và NO3
c,Al và O d, Mn(IV) và O
(Ba=137; H = 1; P= 31; O= 16; Mg=24,Mn=55, Fe=56,Ca=40,S=32,Zn=65,H=1,Cl=35,5,K=39, C=12,Al=27 ,N=14,Na=23,Ag=108)
17.Lập PTHH
a) Na + O2 → Na2O
b) FeS2 + O2 → SO2 + Fe2O3
c) Al + HCl → AlCl3 + H2
d) Na + H2O → NaOH + H2
e) C2H4 + O2 → CO2 + H2O
f) KClO3 → KCl + O2
18.Cho 10,2g Nhôm oxit (Al2O3 ) tác dụng với dung dịch chứa 29,4g Axit Sunfuric (H2SO4 ). Khi phản ứng xảy ra hoàn toàn thu được dung dịch muối Nhôm Sunfat (Al2(SO4)3 )và 5,4g nước
a.Viết phương trình chữ của phản ứng trên
b.Viết công thức về khối lượng của phản ứng
c.Tính khối lượng Nhôm Sunfat thu được
d.Lập phương trình hóa học của phản ứng
19.Lập phương trình hóa học
a.Ca(OH) 2+ CO2 ─ ─> CaCO3 + H2O
b.Fe2O3 + CO ─ ─> Fe+ CO2
- KMnO4─ ─> K2MnO4 + MnO2 + O2
d.H2SO4+ Al (OH) 3 ─ ─> Al2(SO4)3 + H2O
e/ FeCl2 + Cl2 —– > FeCl3
f/ C2H2 + O2 —– > CO2 +H2O
g.FeS2 + O2 ─ ─> SO2 + Fe2O3
h/Mg(OH)2 + H3PO4 → Mg3(PO4)2 +H2O
i .Ca + O2 → CaO
k./ Al + HCl —– > AlCl3 + H2│
l.. Fe2(SO4)3 + Mg ─ ─> MgSO4 + Fe
20.Bổ túc và cân bằng
1.…….. + O2 ─ ─> Na2O
2. Fe +………. ─ ─> Fe3O4
3. KOH + Cu(NO3)2 —– > …….. + KNO3
4. HCl+ Al (OH) 3 ─ ─> ……… + H2O.. .│
5. Fe +HCl àFeCl2 + ……
21. 1 hỗn hợp gồm:2,24 l khí NH3 , 6,4 g phân tử Oxi và 1,8.1023 phân tử hidro.Hãy cho biết:
a.Thể tích của hỗn hợp ở Đktc
b. khối lượng của hỗn hợp
c.Ở khí nào có số phân tử ít nhất
d.ta có thể thu từng khí trên bằng cách để bình ngửa hay úp?tại sao?
22.Tính khối lượng mol của khí A.Biết tỉ khối của A đối với khí oxi là 2,21875.Để thu khí A ta dùng bình ngửa hay úp?tại sao?
23. Lập CTHH của các hợp chất tạo bởi :
S(VI ) và O H và nhóm ClO4 ( I)
24. Tìm hóa trị của : Nhóm OH,K trong
a. NaOH b. K3PO4
25. Hoàn thành các PTHH sau :
a. SO2 + O2 → SO3
b. K + H2O → KOH + H2
c. Al2O3 + HCl → AlCl3 + H2O
d. 4Mg + H2SO4 → MgSO4 + H2S + H2O
e. Cu + O2 → CuO
g. Fe + Cl2 → FeCl3
26. Điền CTHH và hoàn thành PTHH
a. Fe2O3 + …… → Fe + H2O
b. Ca + ……. → Ca(OH)2 + H2
Đề kiểm tra học kì 1 lớp 8 môn Hóa – Phòng GD&ĐT Bình Sơn năm 2016 có đáp án
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO BÌNH SƠN
TRƯỜNG TRUNG HỌC CƠ SỞ BÌNH CHÂU
ĐỀ THI HỌC KÌ 1
MÔN: HÓA – LỚP 8
NĂM HỌC 2016 – 2017
Thời gian làm bài 60 phút
A. TRẮC NGHIỆM: ( 4điểm )
I: Khoanh tròn chữ cái đứng trước câu trả lời đúng:
1. Cho biết công thức hóa học hợp chất của nguyên tố X với O là: XO và hợp chất của nguyên tố Y với H là: YH3 (X; Y là những nguyên tố nào đó). Công thức hóa học đúng cho hợp chất X với Y là:
A. X3Y2 B.X2Y3 C.XY3 D.XY
2. Một mol nguyên tử chứa bao nhiêu hạt nguyên tử ?
A. 6.1025 B. 0,6.1023
C.6.1023 D. 12.1023
3. Cho phương trình hoá học sau: 2Al + 3Cu(NO3)2 2Al(NO3)3 + 3Cu
Tỉ lệ: Số nguyên tử Al : Số phân tử Cu(NO3)2 : Số phân tử Al(NO3)3 : Số nguyên tử Cu lần lượt là:
A. 2 : 1 : 1 : 3 B. 2 : 3 : 2 : 3
C. 2 : 3 : 1 : 3 D. 2 : 3 : 1 : 2
4. Trong hợp chất Fe2O3 phần trăm khối lượng các nguyên tố Fe và O lần lượt là:
A. 50%; 50% B.30%; 70%
C.75%; 25% D.70%; 30%
2: Hãy chọn các cụm từ thích hợp để điền vào (…..) trong các câu sau:
Mỗi công thức hóa học chỉ một ……………… của chất (trừ đơn chất kim loại), cho ta biết ………….. tạo ra chất, số ………………. của mỗi nguyên tố và ……………….
3: Hãy ghép các ý ở cột A tương ứng với các ý ở cột B sao cho phù hợp:
| Cột A | Cột B | Kết quả |
| 1. Nguyên tử 2. Phân tử 3. Đơn chất 4. Hợp chất |
a. Zn, O2, Al2(SO4)3, HCl b. KOH, FeCl2, H2O, Na2CO3 c. O2, Cl2, H2O, NaCl d. Cu, S, H, Oe. O2, Cl2, Fe, Cu |
1. + … 2. + … 3. + … 4. + … |
4: Hãy điền Đ với câu trả lời đúng và S vào câu trả lời sai:
1. Hiện tượng cháy rừng là hiện tượng vật lí. [..]
2. Để phản ứng hóa học xảy ra ta phải đun nóng các chất tham gia phản ứng. [..]
3. Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Các nguyên tử cùng loại có cùng số proton. [..]
4. Ở đktc, thể tích mol của các chất khí điều bằng 24 lít. [..]
B/ TỰ LUẬN:
1:a/ Phát biểu định luật bảo toàn khối lượng. Viết biểu thức.
b/ Vận dụng: Cho 2 gam khí hiđro (H2) tác dụng vừa đủ với 80 gam đồng (II) oxit (CuO), thu được 64 gam đồng kim loại (Cu) và nước (H2O). Tính khối lượng nước thu được.
2: Lập phương trình hóa học của các sơ đồ phản ứng hóa học sau:
a/ Fe + O2 → Fe3O4
b/ Al + CuSO4 → Al2(SO4)3 + Cu
c/ Na2CO3 + CaCl2 → CaCO3 + NaCl
d/ FeS2 + O2 → Fe2O3 + SO2
3: Cho 2,8 gam Fe tác dụng vừa đủ với dung dịch HCl theo phương trình hóa học:
Fe + 2HCl → FeCl2 + H2
a/ Tính khối lượng HCl tham gia phản ứng.
b/ Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn.
(Biết Fe = 56; Cl =35,5; H = 1)
———- HẾT ———–
ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM ĐIỂM
I. PHẦN TRẮC NGHIỆM: (4 điểm)
1: Mỗi câu khoanh tròn đúng được 0,25 điểm.
| Câu | 1 | 2 | 3 | 4 |
| Đáp án | A | C | B | D |
2: Thứ tự cần điền là:
1.Phân tử.
2.Nguyên tử.
3.Số nguyên tử.
4.Phân tử khối.
(Mỗi ý đúng 0,25điểm)
3: Mỗi câu ghép đúng 0,25 điểm.Kết quả ghép: 1. d 2. b, c 3. e 4. b
4: iền chính xác mỗi ý 0,25 điểm.
1. S 3. Đ
2.S 4. S
B.PHẦN TỰ LUẬN:
| Câu | Nội dung | Điểm |
| 1(2 điểm) | – Phát biểu đúng nội dung đinh luật:“Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”.– Viết đúng biểu thức: mA + mB = mC + mD– Tính đúng: = 18 (g) | 0,75điểm0,25điểm1điểm |
| 2(2 điểm) | Lập đúng mỗi PTHH được 0,5 điểm.a/ Fe + O2 → Fe3O4b/ Al + CuSO4 → Al2(SO4)3 + Cuc/ Na2CO3 + CaCl2 → CaCO3 + NaCld/ FeS2 + O2 → Fe2O3 + SO2 | 0,5điểm0,5điểm0,5điểm0,5điểm |

Đáp án đề kiểm tra học kì 1 lớp 8 môn Hóa năm học 2016 – 2017
Đề Kiểm Tra Học Kì 1
Môn: Hóa Học – Lớp 8
Thời gian làm bài 60 phút
Bài 1: Chọn đáp án đúng:
1. Khẳng định nào sau đây là sai:
A. Hợp chất dược tạo nên từ hai nguyên tố trở lên.
B.Chất được chia làm hai loại là đơn chất và hợp chất.
C.Hạt hợp thành đơn chất kim loại là phân tử.
D.Hợp chất có phân tử gồm những nguyên tử khác loại liên kết với nhau.
2. Hiện tượng hóa học là hiện tượng:
| A. Có sự biến đổi chất. | C.Có sự biến đổi hình dạng. |
| B.Có sự biến đổi về trạng thái. | D.Có sự thay đổi nhiệt độ. |
3. Công thức hóa học nào đúng cho hợp chất gồm S(IV) và O
| A. SO2 | B.S2O6 | C.SO3 | D.SO6 |
4. Trong phản ứng hóa học khối lượng được bảo toàn vì:
| A. Phân tử được bảo toàn | C.Số nguyên tử được bảo toàn |
| B.Chất được bảo toàn | D.Nguyên tố được bảo toàn |
5. Tỉ khối của khí Metan (CH4) đối với khí Oxi là:
| A. 1 | B.0,5 | C.0,75 | D.1,25 |
6. Trong hợp chất Fe2(SO4)3 thì sắt có thành phần về khối lượng là:
| A. 28% | B.36,84% | C.73,68% | D.14% |
Bài 2: Hoàn thành các phương trình hóa học:
a/ Zn + O2 —–to–> ZnO
……………………………………………..
b/ Al(OH)3 —–to–> Al2O3 + H2O
……………………………………………..
c/ Mg + HCl —–to–> MgCl2 + H2
……………………………………………..
d/ KOH + H2SO4 —–to–> K2SO4 + H2O
……………………………………………..
e/ C3H6 + O2 —–to–> CO2 + H2O
……………………………………………..
g/ Fe3O4 + CO —–to–> Fe + CO2
……………………………………………..
Bài 3: Một hợp chất có khối lượng mol phân tử là 80 gam và có thành phần gồm 80% Cu và 20% O về khối lượng
a/ Lập công thức hóa học của hợp chất?
b/ Cho 16 gam hợp chất tác dụng hết với axit Clohiđric (HCl). Hãy tính số gam axit cần dùng (biết sản phẩm của phản ứng là muối Đồng (II) Clorua (CuCl2) và nước).
Bài 4: Phân hủy a gam nước thì thu được 0,672 lít hỗn hợp gồm khí Oxi và khí Hiđrô (đo ở đktc). Hãy tính a?
Đề và đáp án đề kiểm tra học kì 1 Hóa 8 Phòng GD & ĐT TX Ba Đồn 2015
1.(2 điểm) Đơn chất là gì? Hợp chất là gì? Cho mỗi loại 2 ví dụ minh họa.
2. (3 điểm)
1. Phát biểu quy tắc hóa trị.
2. Lập công thức hóa học và tính phân tử khối của những hợp chất tạo bởi:
a. Cu(II) và O b. Mg (II) và nhóm OH (I)
(Biết Cu= 64; O = 16 ; Mg = 24 ; H = 1)
3. (2 điểm) Lập phương trình hóa học các phản ứng có sơ đồ sau:
a. Cr + Cl2 CrCl3
b. K + O2 K2O
c. Mg + HCl MgCl2 + H2
d. Fe2O3 + H2SO4 Fe2(SO4)3 + H2O
4. (3 điểm) Cho kim loại magie (Mg) phản ứng với dung dịch axit clohidric (HCl) thu được 1,12 lít khí H2 theo sơ đồ:
Mg + HCl → MgCl2 + H2
a. Lập phương trình hóa học của phản ứng
b. Tính khối lượng Mg đã phản ứng
c. Tính khối lượng của axit clohidric (HCl) ban đầu, biết lượng HCl lấy dư 20% so với lượng cần thiết
(Biết Mg = 24 ; H = 1 ; Cl = 35,5)
ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ 1 MÔN HÓA HỌC 8
1. (2 điểm)
– Đơn chất là những chất được tạo nên từ một nguyên tố hóa học
VD:
– Hợp chất là những chất được tạo nên từ 2 nguyên tố hóa học trở lên. VD:
2. (3 điểm)
1. Trong một CTHH, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
2.
a. CuO
PTK: 80 đvC
b. Mg(OH)2
PTK: 58 đvC
3:
1. 2Cr +3 Cl2 → 2CrCl3
2. 4K + O2 → 2K2O
3. Mg + 2HCl → MgCl2 + H2
4. Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
4.
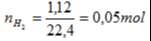
a. Mg + 2HCl ZnCl2 + H2
0,05 mol 0,1 mol 0,05 mol
b. mMg =0,05.24 = 1,2 gam
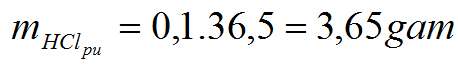
mHClbanđầu = mHClpu + mHCl dư
= 3,65 + 3,65.20% = 4,38gam
Đề kiểm tra học kì 1 môn Hóa 8 phòng GD & ĐT TP Bảo Lộc năm học 2015 – 2016 có đáp án
Thời gian làm bài 45 phút.
A. Phần trắc nghiệm: (4đ)
1: Các nguyên tử của cùng một nguyên tố hóa học có cùng:
A. Khối lượng
B.Số proton
C.Số Nơtron
D.Cả B, C.
2: Cho công thức hóa học của một số chất sau: N2 ; Fe2O3 ; S ; H2SO4 ; Zn ; MgO. Trong số các chất đó có:
A. 4 đơn chất, 2 hợp chất
B.3 đơn chất, 3 hợp chất
B.2 đơn chất, 4 hợp chất
D.1 đơn chất, 5 hợp chất
3: Một kim loại M tạo muối sunfat là M2(SO4)3. Muối nitrat của kim loại M là:
A. M(NO3)3
B.M2(NO3)3
C.MNO3
D.M2NO3
4: Một hỗn hợp khí gồm 0,5mol O2 và 8,8g CO2. Thể tích hỗn hợp khí này ở đktc là:
A. 15,68 lít
B.17,92 lít
C.20,16 lít
D.22,4 lít
5: Hiện tượng nào sau đây là hiện tượng hóa học:
A. Nước đá tan chảy
B.Muối ăn tan trong nước
C.Cồn để trong lọ không kín bị bay hơi
D.Sắt bị “gỉ sét”
6: Ở điều kiện tiêu chuẩn, một mol bất kì chất khí nào cũng có thể tích:
A. Bằng nhau
B.22 lít
C.22,4 lít
D.24 lít
7: Khi thổi hơi thở nhẹ vào ống nghiệm đựng nước vôi trong. Hiện tượng quan sát được là:
A. Sủi bọt khí
B.Nước vôi trong bị đục
C.Nước vôi trong chuyển sang màu hồng
D.Không có hiện tượng gì
8: Cho hợp chất oxit sắt FexOy, hoá trị của sắt trong hợp chất oxit này là:
A. y
B.y/x
C.2y/x
D.2x/y
B.Phần tự luận: (6đ)
9: Hoàn thành các PTHH sau:
1. Na + Cl2 —– > NaCl
2. Mg + O2 —— > MgO
3. K + H2O —— > KOH + H2O
3. Al + CuSO4 —— > Al2(SO4)3 + Cu
10: Một hợp chất X có thành phần phần trăm khối lượng mỗi nguyên tố là:
%S = 40% và %O = 60%. Xác định công thức hóa học của X. biết tỉ khối của X đối với khí oxi là 2,5.
11: Phản ứng hóa học xảy ra khi đốt cháy rượu etylic là:
C2H6O + O2 —— > CO2 + H2O
1. Hãy lập PTHH của phản ứng.
2. Cho biết tỉ lệ số phân tử của các chất trong phản ứng hóa học
3. Tính thể tích khí oxi (ở đktc) cần thiết để đốt cháy hết 4,6g rượu etylic và tính khối lượng khí CO2 tạo thành.
(Biết C = 12, H = 1, O = 16)
ĐÁP ÁN VÀ BIỂU ĐIỂM MÔN HÓA 8
A) Phần trắc nghiệm: (4đ)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | B | B | A | A | D | C | B | C |
| Điểm | 0,5đ | 0,5đ | 0,5đ | 0,5đ | 0,5đ | 0,5đ | 0,5đ | 0,5đ |
B.Phần tự luận: (6đ)
9: (2đ)
Chọn hệ số và lập đúng mỗi PTHH : 0.5đ
10: (1đ)
Tính đúng MX = 2,5 x 32 = 80g (0,25đ)
Lập tỉ lệ tìm chỉ số x = 1 và y = 3 (0,5đ)
Viết công thức hóa học của X là SO3 (0,25đ)
11: (3đ)
a.Lập đúng PTHH: C2H6O + 3O2 2CO2 + 3H2O (1) (0,5đ)
b.Tỉ lệ số Ptử: C2H6O: số ptử O2 : số ptử CO2 : số ptử H2O = 1: 3: 2: 3 (0,5đ)
c. Tính đúng số mol C2H6O = 0,1 mol (0,5đ)
Từ (1) => số mol CO2 = 0,2 mol => khối lượng CO2 = 8,8g (0,75đ)
Số mol O2 = 0,3 mol => thể tích O2 = 6.72 lit (0,75đ)
Đề cương ôn tập học kì 1 Hóa 8 năm 2015
SỞ GIÁO GD- ĐT BÀ RỊA VŨNG TÀU
HỘI ĐỒNG BỘ MÔN HÓA HỌC
ĐỀ CƯƠNG ÔN TẬP HỌC KỲ I
MÔN : HÓA HỌC 8 NĂM HỌC 2015-2016
I.Lý thuyết :
– Khái niệm: Nguyên tử, Nguyên tố hóa học, Phân tử, Đơn chất, Hợp chất; Nhận biết các nguyên tố kim loại và phi kim;
– Nguyên tử khối, Phân tử khối;
– KHHH và hóa trị của nguyên tố và nhóm nguyên tử;
– CTHH đơn chất, hợp chất và ý nghĩa của CTHH;
– Các cách xác định hóa trị, qui tắc hóa trị;
– Sự biến đổi của chất, phản ứng hóa học (diễn biến, dấu hiệu và điều kiện xảy ra phản ứng hóa học);
– Nội dung và biểu thức của Định luật BTKL;
– Các bước lập PTHH và ý nghĩa của PTHH;
– Khái niệm: Mol, khối lượng mol, thể tích mol chất khí, các công thức chuyển đổi giữa các đại lượng
– Tỉ khối của chất khí và cách xác định;
– Các bước giải bài toán tính theo CTHH và tính theo PTHH.
II. Các dạng bài tập:
- Bài tập định tính
– Vận dụng qui tắc hóa trị để: Xác định hóa trị của nguyên tố hay nhóm nguyên tử; vận dụng để lập CTHH;
– Từ CTHH phân biệt đơn chất, hợp chất và ngược lại;
– Lập PTHH đơn giản và phức tạp; Xác định tỉ lệ số nguyên tử, phân tử trong PTHH;
- Bài tập định lượng
– Vận dụng NTK, PTK để xác định NTHH và lập CTHH;
– Dựa vào tỉ khối xác định độ nặng nhẹ giửa các chất khí;
– Các bài tập giải:
+ Áp dụng tính theo CTHH: Để tính thành phần % khối lượng các nguyên tố trong hợp chất và ngược lại.
+ Tính theo PTHH , Định luật bảo toàn khối lượng để tính: số mol, khối lượng mol các chất và thể tích mol của chất khí
- Bài tập thí nghiệm thực hành
– Vận dụng kiến thức tính chất của chất: tách các chất ra khỏi hỗn hợp;
– Quan sát, tiến hành và giải thích các hiện tượng thí nghiệm.
– Thông qua thí nghiệm nhận biết dấu hiệu có phản ứng hóa học xảy ra;
– Dựa vào tỉ khối của chất khí: Biết cách thu một số khí trong PTN;
- Phần mở rộng.
– Giải thích một số hiện tượng thực tế bằng kiến thức hóa học.
– Bài tập tổng hợp: Vận dụng NTK, PTK tính theo CTHH và theo PTHH để giải bài tập tổng hợp.
Đề cương cụ thể và một số bài tập tham khảo Môn hóa lớp 8 học kì 1
A. LÝ THUYẾT
- Khái niệm nguyên tử, phân tử, nguyên tử khối, phân tử khối.
– Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm :
– Hạt nhân tạo bởi proton(p) và nơtron
– Trong mỗi nguyên tử : số p(+) = số e (-)
– Electron luôn chuyển động quanh hạt nhân và sắp xếp thành từng lớp.
– NTHH là tập hợp những nguyên tử cùng loại, có cùng số p trong hạt nhân.
– Kí hiệu hóa học biểu diễn nguyên tố và chỉ một nguyên tử của nguyên tố đó.
– Nguyên tử khối là khối lượng của nguyên tử tính bằng đơn vị cacbon. Mỗi nguyên tố có nguyên tử khối riêng biệt.
– Phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất.
– Phân tử khối là khối lượng của phân tử tính bằng đơn vị cacbon, bằng tổng nguyên tử khối của các nguyên tử trong phân tử.
- Thế nào là đơn chất , hợp chất. Cho ví dụ?
– Đơn chất là những chất tạo nên từ một nguyên tố hóa học. Ví dụ: khí hiđro, KL natri,…
– Hợp chất là những chất tạo nên từ hai nguyên tố hóa học trở lên. Ví dụ : Nước tạo nên từ hai nguyên tố hóa học là H và O.
- Công thức hóa học dùng biểu diễn chất:
+ CTHH Đơn chất : A ( đơn chất kim loại và một vài phi kim như : S,C … )
+ CTHH Đơn chất : Ax ( phần lớn đơn chất phi kim, thường x = 2 )
+ CTHH Hợp chất : AxBy ,AxByCz …
– Mỗi công thức hóa học chỉ một phân tử của chất ( trừ đơn chất A ) và cho biết:
+ Nguyên tố tạo ra chất.
+ Số nguyên tử của mỗi nguyên tố và phân tử khối.
- Phát biểu quy tắc hóa trị . Viết biểu thức.
– Hóa trị của nguyên tố ( hay nhóm nguyên tử ) là con số biểu thị khả năng liên kết của nguyên tử ( hay nhóm nguyên tử ), được xác định theo hóa trị của H chọn làm một đơn vị và hóa trị của O là hai đơn vị
– Quy tắc hóa trị : Trong công thức hóa học,tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia (nhóm nguyên tử)
– Biểu thức :
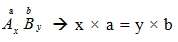
(B có thể là nhóm nguyên tử), ví dụ: Ca(OH)2 ,ta có 1 × II = 2 × 1
Vận dụng :
+ Tính hóa trị chưa biết : biết x,y và a ( hoặc b) tính được b (hoặc a)
+ Lập công thức hóa học khi biết a và b :
– Viết công thức dạng chung
– Viết biểu thức quy tắc hóa trị, chuyển tỉ lệ : (x =a (a’); y=b (b’))
- Sự biến đổi của chất :
– Hiện tượng chất biến đổi mà vẫn giữ nguyên là chất ban đầu được gọi là hiện tượng vật lý.
– Hiện tượng chất biến đổi có tạo ra chất khác, được gọi là hiện tượng hóa học.
- Phản ứng hóa học :
– Phản ứng hóa học là quá trình biến đổi từ chất này thành chất khác.
– Trong phản ứng hóa học chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
– Phản ứng xảy ra được khi các chất tham gia tiếp xúc với nhau, có trường hợp cần đun nóng, có trường hợp cần chất xúc tác.
– Nhận biết phản ứng xảy ra dựa vào dấu hiệu có chất mới tạo thành : Có tính chất khác như màu sắc,trạng thái. Hoắc sự tỏa nhiệt và phát sáng.
- Định luật bảo toàn khối lượng : A + B → C + D
– Định luật : Trong một phản ứng hóa hoc, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng.
– Biếu thức : mA + mB = mC + mD
- Phương trình hóa học : Biểu diễn ngắn gọn phản ứng hóa học.
– Ba bước lấp phương trình hóa học : Viết sơ đồ phản ứng; Cân bằng phương trình; Viết phương trình hóa học
– Phương trình hóa học cho biết tỉ lệ về số nguyên tử, số phân tử giữa các chất cũng như từng cặp chất trong phản ứng.
- Các công thức chuyển đổi giữa khối lượng, thể tích và lượng chất.
– Mol (n) là lượng chất có chứa N nguyên tử hoặc phân tử của chất đó.
con số 6.1023 là số Avogađro, kí hiệu là N
– Khối lượng mol (M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó
– Thể tích mol (l) của chất khí là thể tích chiếm bởi N phân tử của chất khí đó.
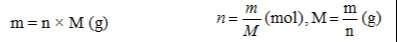
– Thể tích khí chất khí :
+ Ở điều kiện tiêu chuẩn :
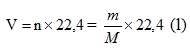
+ Ở điều kiện thường:
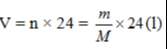
10. Tỷ khối của chất khí.
– Khí A đối với khí B : dA /B = MA/MB
– Khí A đối với không khí :dA /kk = MA/29
11. Tính theo CTHH và theo PTHH
– Tính theo CTHH: Từ thành phần % khối lượng các nguyên tố xác định CTHH và ngược lại.
– Dựa vào PTHH tính khối lượng chất tham gia, chất sản phẩn, thể tích các chất theo PTHH
B.BÀI TẬP
Dạng bài tập 1: Phân loại đơn chất, hợp chất
Phân loại các chất sau theo đơn chất, hợp chất: khí hidro, nước , đường saccarozo (C12H22O11), nhôm oxit (Al2O3), Canxi cacbonat (CaCO3), khí cacbonic (CO2), muối ăn (NaCl), dây đồng, bột lưu huỳnh, khí Clo.
Dạng bài tập 2: Hóa trị
a) Tính hóa trị của nguyên tố N trong hợp chất N2O5
Giải: Gọi a là hóa trị của nguyên tố N trong hợp chất N2O5 (a>O)
Ta có: a II
N2O5 ⇔ a.2 = 5.II ⇔ a = 5.II/2 ⇔ a = V Vậy trong CT hợp chất N2O5 thì N(V)
b) Tính hóa trị của nguyên tố S trong hợp chất SO2
Giải: Gọi a là hóa trị của nguyên tố S trong hợp chất SO2 (a>O)
Ta có: a II
SO2 ⇔ a.1 = 2.II ⇔ a = 2.II ⇔a = IV Vậy trong CT hợp chất SO2 thì S(IV)
c) Tính hóa trị của nhóm PO4 trong hợp chất Ca3(PO4)2 , biết nguyên tố Ca(II)
Giải: Gọi b là hóa trị của nhóm PO4 trong hợp chất Ca3(PO4)2
Ta có: II b
Ca3(PO4)2 ⇔3.II = 2.b ⇔b =3.II/2 ⇔b = III Vậy trong CT hợp chất Ca3(PO4)2 thì PO4 (III)
Câu1: Xác định nhanh hóa trị của mỗi nguyên tố hoặc nhóm nguyên tử trong các hợp chất sau đây: NO ; NO2 ; N2O3 ; N2O5; NH3; HCl; H2SO4; H3PO4; Ba(OH)2; Na2SO4; NaNO3; K2CO3 ; K3PO4 ; Ca(HCO3)2 Na2HPO4 ; Al(HSO4)3 ; Mg(H2PO4)2
2: Lập nhanh CTHH của những hợp chất sau tao bởi:
P (III) và O; N (III)và H; Fe (II) và O; Cu (II) và (OH); Ca và (NO3); Ag và (SO4), Ba và (PO4); Fe (III) và (SO4), Al và (SO4); NH4 (I) và NO3
Dạng bài tập 3: Định luật bảo toàn khối lượng
1: Có thể thu được kim loại sắt bằng cách cho khí cacbon monoxit CO tác dụng với chất sắt (III) oxit . Khối lượng của kim loại sắt thu được là bao nhiêu khi cho 16,8 kg CO tác dụng hết với 32 kg sắt (III) oxit thì có 26,4 kg CO2 sinh ra.
2: Khi nung nóng quặng đồng malachite, chất này bị phân hủy thành đồng (II) oxit CuO, hơi nước và khí cacbonic.
Tính khối lượng của khí cacbonic sinh ra nếu khối lượng malachite mang nung là 2,22g, thu được 1,60 g đồng II oxit và 0,18 g nước.
– Nếu thu được 6 g đồng (II) oxit; 0,9 g nước và 2,2 g khí cacbonic thì khối lượng quặng đem nung là bao nhiêu?
Dạng bài tập 4: Phương trình hóa học
Chọn hệ số thích hợp để cân bằng các phản ứng sau:
1/ Al + O2 → Al2O3
2/ K + O2 → K2O
3/ Al(OH)3 t0 → Al2O3 + H2O
4/ Al2O3 + HCl → AlCl3 + H20
5/ Al + HCl → AlCl3 + H2↑
6/ Fe0 + HCl → FeCl2 + H20
7/ Fe203 + H2S04 → Fe2(S04)3 + H20
8/ Na0H + H2S04 → Na2S04 + H20
9/ Ca(0H)2 + FeCl3 → CaCl2 + Fe(0H)3 ↓
10/ BaCl2 + H2S04 → BaS04↓ + HCl
11/ Fe(0H)3 t0→ Fe203 + H20
12/ Fe(0H)3 + HCl → FeCl3 + H20
13/ CaCl2 + AgN03 → Ca(N03)2 + AgCl ↓
14/ P + 02 t0→ P205
15/ N205 + H20 → HN03
16/ Zn + HCl → ZnCl2 + H2↑
17/ Al + CuCl2 → AlCl3 + Cu
18/ C02 + Ca(0H)2 → CaC03↓ + H20
19/ S02 + Ba(0H)2 → BaS03↓ + H20
20/ KMn04 t0 → K2Mn04 + Mn02 + 02↑
Dạng bài tập 5: Chuyển đổi giữa khối lượng, thể tích và lượng chất
1: Hãy tính :
- Số mol CO2 có trong 11g khí CO2 (đktc)
- Thể tích (đktc) của 9.1023 phân tử khí H2
2: Hãy cho biết 67,2 lít khí oxi (đktc)
- Có bao nhiêu mol oxi?
- Có bao nhiêu phân tử khí oxi?
- Có khối lượng bao nhiêu gam?
3: Một hỗn hợp gồm 1,5 mol khí O2; 2,5 mol khí N2; 1,2.1023 phân tử H2 và 6,4 g khó SO2.
- Tính thể tích của hỗn hợp khí đó ở đktc.
- Tính khối lượng của hỗn hợp khí trên.
Dạng bài tập 6: Tính theo công thức hóa học:
- Tính thành phần phần trăm về khối lượng
VD1: Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong hợp chất NaOH
Ta có: MNAOH= 23+16+1= 40 (g)
⇒%Na = 23/40. 100% = 57,5 (%) ; %O = 16/40.100% = 40 (%) ; %H = 1/40.100% = 2,5 (%)
VD2: Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong hợp chất Fe(OH)3
Ta có: MFe(OH)3 = 56+(16+1).3 = 107 (g)
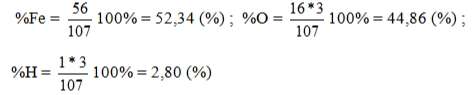
1: Tính phần trăm khối lượng của các nguyên tố trong hợp chất: NaNO3; K2CO3 , Al(OH)3, SO2, SO3, Fe2O3.
2: Xác định CTHH của hợp chất giữa nguyên tố X với O có %X = 43,67%. Biết X có hóa trị V trong hợp chất với O. (ĐS: P2O5)
3: Hợp chất B có %Al = 15,79%; %S = 28,07%, còn lại là O. Biết khối lượng mol B là 342.Viết CTHH dưới dạng Alx(SO4)y .Xác định CTHH. (ĐS: Al2(SO4)3 )
4:Một hợp chất khí X có tỉ khối đối với hidro là 8,5. Hãy xác định công thức hóa học của X biết hợp chất khí có thành phần theo khối lượng là 82,35% N và 17,65% H.(ĐS: NH3)
5: Một hợp chất X của S và O có tỉ khối đối với không khí là 2,207.
a.Tính MX (ĐS: 64 đvC)
b.Tìm công thức hóa học của hợp chất X biết nguyên tố S chiếm 50% khối lượng, còn lại là O. (ĐS: SO2)
Dạng bài tập 7: Tính theo phương trình hóa học
1: Cho 11,2gam Fe tác dụng với dung dịch HCl. Sau phản ứng thu được Sắt (II) clorua (FeCl2) và khí hidro (H2) .
a. Lập PTHH của phản ứng
b. Cho biết tỉ lệ số nguyên tử, số phân tử của từng cặp chất trong phản ứng
c. Thể tích khí H2 thu được ở đktc.(ĐS:4,48 lít)
d. Khối lượng HCl phản ứng.(ĐS:14,6 g)
e. Khối lượng FeCl2 tạo thành.(ĐS:25,4 g)
2: Cho phản ứng: 4Al + 3O2 → 2Al2O3. Biết có 2,4.1022 nguyên tử Al phản ứng.
a. Tính thể tích khí O2 đã tham gia phản ứng ở đktc. Từ đó tính thể tích không khí cần dùng . Biết khí oxi chiếm 1/5 thể tích của không khí.( ĐS: 0,672 lít; 3,36 lít)
b. Tính khối lượng Al2O3 tạo thành.(ĐS: 2.04 g)
3: Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Phương trình hoá học của phản ứng là S + O2 SO2 . Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất ? Vì sao ?
b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1,5 mol nguyên tử lưu huỳnh.(ĐS: 33.6 lít)
c) Khí sunfurơ nặng hay nhẹ hơn không khí ?
Câu 4: Đốt cháy hết 11,2 lít khí A trong oxi, sau phản ứng thu được khí CO2 và hơi nước. Biết khí A có tỉ khối đối với không khí là 0,552. Thành phần theo khối lượng của khí A là:75%C và 25%H (thể tích các khí đo ở đktc)
– Xác định CTHH của khí A
– Viết PTHH của phản ứng
– Tính thể tích khí oxi cần để đốt cháy hết lượng khí A nói trên.
– Tính thể tích và khối lượng khí CO2 thu được sau phản ứng.
– Tính khối lượng của nước thu được bằng hai cách
Dạng bài tập 8: Bài tập thí nghiệm thực hành
Bài 1: Giải thích một số hiện tượng thí nghiệm
Bài 2: Qua một số thí nghiệm: Nêu những dấu hiệu để nhận biết phản ứng xảy ra. Điều kiện của phản ứng đó.
Bài 3: Tách chất ra khỏi hỗn hợp
Dạng bài tập 9: Vận dụng kiến thức hóa học vào giải quyết tình huống thực tiễn
? Vì sao nước vôi để lâu ngày có lớp váng mỏng phía trên hoặc giải thích hiện tượng quét vôi trắng lên tường.
? Hiện tượng nghẹt thở hoặc chết do vào hang động hoặc xuống giếng sâu để lâu ngày
? Dùng khí H2 bơm kinh khí cầu . . ..
Một số Câu hỏi, bài tập tham khảo ôn thi, kiểm tra học kì 1 môn Hóa 8
A. LÝ THUYẾT
Bài 1 : Nước
– Thành phần định tính và định lượng của nước.
– Tính chất vật lí của nước.
– Vẽ sơ đồ tư duy thể hiện tính chất hóa học của nước, viết PTHH minh họa cho từng tính chất.
– Vai trò của nước trong đời sống và sản xuất.
Bài 2: Dung dịch
Phân biệt được dung môi, chất tan, dung dịch, dung dịch bão hoà, dung dịch chưa bão hoà
Bài 3: Nồng độ dung dịch
Nắm được định nghĩa và các công thức tính nồng độ dung dịch
Bài 4: CÁC LOẠI HỢP CHẤT VÔ CƠ : Oxit- Axit – Bazơ- Muối
– Nắm được khái niệm.
– Phân loại và nêu cách gọi tên.
* HS: Nên vẽ sơ đồ tư duy để hệ thống lại kiến thức về các loại hợp chất vô cơ
B.Một số công thức cần nhớ:
1) Sơ đồ chuyển đổi giữa m, n, V:
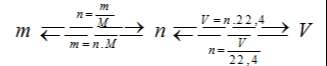
* Trong đó :
+m là khối lượng chất(g)
+ n là số mol (mol)
+ V là thể thích chất khí (ở đktc)(l)
+ M là khối lượng mol(g)
2) Công thức tính nồng độ dung dịch:
a) Nồng độ mol dung dịch
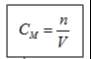
Trong đó: CM : là nồng độ mol dung dịch (M) hoặc (mol/l)
n : là số mol chất tan( mol)
V là thể tích dung dịch(l)
b) Nồng độ phần trăm dung dich:
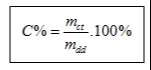
Trong đó: C% : là nồng độ phần trăm dung dịch (%)
mct: là khối lượng chất tan(g)
mdd : là khối lượng dung dịch(g)
C.BÀI TẬP
Bài 1: Cho các chất sau: SO3, Fe, K2O, P2O5, CuO, CaO, Na. Cho biết chất nào tác dụng được với nước. Viết PTHH xảy ra và đọc tên chất sản phẩm tạo thành.
Bài 2: Viết PTHH thực hiện dãy biến hóa sau:
a) K (1) → K2O (2) → KOH
c) P → P2O5 → H3PO4
Bài 3: Cho các chất sau: CaO, HCl, KH2PO4, H2SO3, FeSO4, NaCl, CaCO3, SO2, Cu(OH)2, NaOH, AlPO4, NaHCO3, CO2, P2O5, KOH, CuSO4, HNO3.
a) Hãy phân loại và đọc tên các chất trên
b) Chất nào phản ứng được với nước ở nhiệt độ thường. Viết PTHH xảy ra.
Bài 4: Cho 13g kẽm tác dụng với dung dịch loãng có chứa 24,5g axitsunfuric.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Cho khí sinh ra đi qua bột đồng(II) oxit, đun nóng. Tính khối lượng đồng thu được?
Bài 5: Cho 4,6g natri tác dụng với 90g nước ở nhiệt độ thường.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí hiđro thu được (ở đktc).
c) Cho khí sinh ra đi qua bột sắt (III) oxit dư, đun nóng. Tính khối lượng sắt thu được?
Bài 6: Cho 10g chất rắn A tác dụng với 6,3g nước ở nhiệt độ thường thu được dung dịch
B.Dung dịch B làm quỳ tím hóa xanh.
a) Dung dịch B thuộc loại hợp chất vô cơ nào?
b) Nếu A là Canxi. Viết PTHH?
c) Tính thể tích khí hiđro thu được (ở đktc)
Bài 7:
1) Hãy tính nồng độ phần trăm của các dung dịch:
a) Hòa tan 25g CuSO4 vào 150g nước
b) Hòa tan 30g BaCl2 vào 70g nước
2) Hãy tính nồng độ mol của các dung dịch sau:
a) 0,3mol Na2CO3 trong 4 lít dung dịch
b) 400g CuSO4 trong 4000ml dung dịch
Bài 8:
1) Trong 800ml dung dịch có hòa tan 14,6g HCl. Tính nồng độ mol của dung dịch HCl.
2) Hòa tan 200g muối (CuSO4) vào nước, được dung dịch muối có nồng độ 25%. Hãy tính:
a) Khối lượng dung dịch muối pha chế được.
b) Khối lượng nước cần cho sự pha chế.
Bài 9: Cho 4,6 g natri tác dụng với nước thu được 200ml dung dịch natri hiđroxit và khí hiđro. Tính nồng độ mol dung dịch natri hiđroxit
Bài 10: Hãy phân biệt các chất sau bằng phương pháp hóa học
a) Ba chất rắn: CaO, P2O5, SiO2 (cát)
b) Ba dung dịch: NaOH, H2SO4, NaCl
Cho biết nguyên tử khối: S=32; O=16; H=1, Cu=64, Cl=35,5, Na=23
Bộ đề thi học kì 1 môn Hóa học lớp 8 năm 2019 – 2020
Đề kiểm tra học kì 1 lớp 8 môn Hóa học
Đề bài
Phần I- Trắc nghiệm khách quan: (3 điểm)
Hãy khoanh tròn vào một trong các chữ cái đứng trước đáp án đúng
Câu 1: Phản ứng nào sau đây thuộc loại phản ứng hóa hợp:
A. 2HgO → 2Hg + O2
B. CaO + CO2 → CaCO3
C. Ca(OH)2+ 2HCl -> CaCl2+ 2H2O
D. 4Al + 3O2 → 2Al2O3
Câu 2: Đốt cháy hoàn toàn 2,4g magie trong không khí, khối lượng magie oxit thu được là:
A. 5g.
B. 4g.
C. 2g.
D. 8g.
Câu 3: Thành phần theo thể tích của không khí gồm :
A. 21% N2, 78% O2, 1% các khí khác
B. 21% các khí khác, 78% N2, 1% O2
C. 21% O2, 78% N2 ; 1% các khí khác
D. 21% O2 , 78% các khí khác, 1% N2
Câu 4: Hiện tượng xảy ra khi nhốt con dế trong lọ đậy kín.
A. Con dế chết vì thiếu Oxi.
B. Con dế vẫn sống bình thường.
C. Con dế chết vì thiếu nước.
Câu 5: Khí nào sau đây trong không khí gây nên hiệu ứng nhà kính:
A. Khí H2
B. Khí Oxi.
C. Khí CO2
D. Khí N2.
Câu 6: Nguyên liệu để điều chế Oxi trong phòng thí nghiệm là:
A. Na2SO4
B. H2O
C. MnO2
D. KMnO4
PHẦN II –TỰ LUẬN (7 điểm)
Câu 7: (1 điểm)
Đọc tên và phân loại các oxit sau: P2O5, Fe2O3, SO2, Na2O
Câu 8: (1 điểm)
Để dập tắt ngọn lửa do xăng dầu cháy, người ta thường chùm vài dày lên ngọn lửa mà không dùng nước ? Giải thích vì sao ?
Câu 9: (2 điểm) Viết phương trình hóa học biểu diễn sự cháy của các chất: Cacbon, photpho, etilen (C2H4), nhôm trong khí oxi.
Câu 10: (3 điểm) Đốt cháy hoàn toàn 5,4 g bột nhôm cần V(l) khí oxi ở (đktc).
A. Viết PTHH và tính V.
B. Tính khối lượng kali pemanganat cần dùng để điều chế lượng oxi đủ cho phản ứng trên, biết rằng thực tế đã dùng dư KMnO4 10% so với lý thuyết.
(Cho Al = 27; O = 16; K = 39; Mn = 55
Đáp án
I. TRẮC NGHIỆM (3 điểm).
| Câu | Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 | Câu 6 |
| Đáp án | D | B | C | A | C | D |
II. PHẦN TỰ LUẬN (7 đ)
| CÂU | Ý | NỘI DUNG | ĐIỂM |
| Câu 1 | – HS phân loại đúng mỗi oxit được 0,25 điểm- HS gọi tên đúng mỗi oxit được 0,25 điểm | 0,50,5 | |
| Câu 2 | – HS giải thích được dùng vải dày để dập tắt đám cháy do xăng dầu vì để ngăn không cho chất cháy tiếp xúc với oxi trong không khí.- HS giải thích không dùng nước vì xăng dầu không tan trong nước và nhẹ hơn nước nên sẽ nổi lên và làm đám cháy lan rộng hơn. | 0,5 0,5 | |
| Câu 3 | HS viết đúng mỗi phương trình phản ứng được 0.5 điểm. Viết sai một công thức của phương trình thì không cho điểm. Không cân bằng thì chỉ cho 0,25 điểm phương trình đó | 2 | |
| Câu 4 | a. PTHH:4Al + 3O2 → 2Al2O3Tính được : nAl = 0,2 molTheo PTHH tính được : nO2 = 0,15 molTính được: VO2 = 0,15.22,4 = 3,36 lb. 2KMnO4 → K2MnO4 + MnO2 + O2Theo PTHH tính được: nKMnO4 = 0,3 molmKMnO4LT = 0,3.158 = 47,4 gmKMnO4TT = (47,4.110): 100 = 52,14 g | 0, 5 0,250,250,5 0,50,250,250,5 |
Đề thi hóa 8 học kì 1 (Đề 1)
I. TRẮC NGHIỆM
Chọn một trong những chữ cái A, B, C, D cho đúng nhất.
Câu 1: Hóa trị của Fe trong hai hợp chất FeCl3, FeCl2 là:
A. I
B. III, II
C. I, III
D. I, II
Câu 2: Cho các kí hiệu và các công thức hóa học: Cl, H, O, C, CO2, Cl2, H2, O2. Dãy gồm các đơn chất là:
A. Cl, H, O, C
B. CO2, Cl2, H2, O2
C. C, Cl2, H2, O2
D. CO2, Cl, H, O2
Câu 3: Các nguyên tử của cùng một nguyên tố hóa học có cùng
A. khối lượng
B. số proton
C. số nơtron
D. cả A, B, C
Câu 4: Công thức hóa học dung để biểu diễn:
A. hợp chất
B. chất
C. đơn chất
D. hỗn hợp
Câu 5: Một kim loại M tạo muối sunfat M2(SO4)3. Muối nitrat của kim loại M là:
A. M(NO3)3
B. M2(NO3)2
C. MNO3
D. M2NO3
Câu 6: Trong nguyên tử luôn có:
A. số proton bằng số nơtron
B. số proton bằng số electron
C. số nowtron bằng số electron
D. số proton bằng số electron bằng số nơtron
II. TỰ LUẬN
Câu 1: Cân bằng các phương trình phản ứng hóa học sau:
Al + S −to→ Al2S3
NaOH + FeCl3 → Fe(OH)3 +NaCl
K + H2O → KOH + H2
Fe + Cl2 −to→ FeCl3
Câu 2: Lập công thức hóa học của các hợp chất hai nguyên tố sau: Ca và O; Al và Cl.
Câu 3: Tính khối lượng mol của các chất sau: H2O, Al2O3, Mg3(PO4)2, Ca(OH)2.
Câu 4: Tính thành phần phần trăm (theo khối lượng) các nguyên tố hóa học có trong các hợp chất sau: MgO và Fe2O3.
Câu 5:
Tính khối lượng của 4,48 lít khí SO3 (ở đktc).
Tính thể tích ở đktc của 6,4 gam khí CH4.
(Cho biết H=1, O=16, Al=27, Ca=40, P=31, Mg=24, S=32, C=12, Fe=56).
Đáp án và hướng dẫn giải
I. TRẮC NGHIỆM
Câu 1: chọn B
Hướng dẫn: +) Trong FeCl3 → x.I = 3.I → x = III
+) Trong FeCl2 → y.I = 2.I → y = II
Câu 2: chọn C
Hướng dẫn: Đơn chất là những chất tạo nên từ 1 nguyên tố hóa học.
Câu 3: chọn B
Câu 4: chọn B
Câu 5: chọn A
Hướng dẫn: Từ M2(SO4)3 → a.2 = 3.II → a = III → Công thức muối nitrat của kim loại M là M(NO3)3.
Câu 6: chọn B
II. TỰ LUẬN
Câu 1: Cân bằng phản ứng hóa học:
2Al + 3S −to→ Al2S3
3NaOH + FeCl3 → Fe(OH)3 ↓ + 3NaCl
2K + 2H2O → 2KOH + H2 ↑
2Fe + 3Cl2 −to→ 2FeCl3
Câu 2:
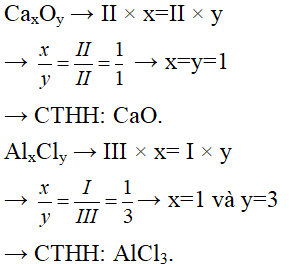
Câu 3:
H2O = 2×1+16 =18 (gam)
Al2O3 = 27×2+16×3 = 102 (gam)
Mg3(PO4)2 = 24×3+95×2 =262 (gam)
Ca(OH)2 = 40+34 =74 (gam)
Câu 4:
MgO: %Mg = 24/40 x 100% = 60%
%O = 100% – 60% = 40%
Fe2O3: %Fe = 112/160 x 100% = 70%
%O = 100% – 70% = 30%
Câu 5:
nSO3= 4,48/22,4=0,2 (mol) → mSO3= 0,2 x 80 = 16 (gam).
nCH4= 6,4/16 = 0,4 (mol) → VCH4= 0,4 x 22,4 = 8,96 (lít).
Đề thi hóa 8 học kì 1 (Đề 2)
I. TRẮC NGHIỆM
Hãy khoanh tròn một trong các chữ cái (A, B, C, D) đứng trước câu trả lời đúng nhất.
Câu 1: Phương pháp chứng cất được dung để tách một hỗn hợp gồm:
A. nước với muối ăn
B. nước với rượu
C. cát với đường
D. bột sắt với lưu huỳnh
Câu 2: Cho các công thức hóa học của một số chất như sau: oxi O2, bạc clorua AgCl, magie oxit MgO, kim loại đồng Cu, kali nitrat KNO3, natri hidroxit NaOH.
Trong các chất trên có mấy đơn chất, mấy hợp chất?
A. 3 đơn chất và 3 hợp chất
B. 1 đơn chất và 5 hợp chất
C. 4 đơn chất và 2 hợp chất
D. 2 đơn chất và 4 hợp chất
Câu 3: hai nguyên tử khác nhau, muốn có cùng kí hiệu hóa học phải có tính chất:
A. cùng số elctron trong nhân
B. cùng số nowtron trong nhân
C. cùng số proton trong nhân
D. cùng khối lượng
Câu 4: Từ công thức hóa học K2CO3 cho biết ý nào đúng?
Hợp chất trên do 3 đơn chất K, C, O tạo nên.
Hợp chất trên do 3 nguyên tố K, C, O tạo nên.
Hợp chất trên có phân tử khối 138 đvC (K=39, c=12, O=16).
Hơp chất trên là hỗn hợp 3 chất kali, cacbon, oxi.
A. 1, 2, 3
B. 2, 3, 4
C. 1, 4
D. 2, 3
Câu 5: Theo hóa trị của sắt trong Fe2O3, hãy chọn công thức hóa học đúng của hợp chất gồm Fe liên kết với nhóm nguyên tử SO4(II).
A. Fe2(SO4)3
B. FeSO4
C. Fe3(SO4)2
D. Fe2SO4
Câu 6: Phải lấy bao nhiêu gam kim loại sắt để có số nguyên tử nhiều gấp 2 lần số nguyên tử có trong 8 gam lưu huỳnh?
A. 29 gam
B. 28 gam
C. 28,5 gam
D. 56 gam
II. TỰ LUẬN
Câu 7:
Tính hóa trị của nguyên tố P trong hợp chất P2O5.
Lập công thức hóa học và tính khối lượng mol của hợp chất gồm Al(III) lien kết với nhóm SO4(II). (Al=27, S=32, O=16)
Câu 8: Cho sơ đồ các phản ứng sau:
Al + O2 −to→ Al2O3
P2O5 + H2O H3PO4
KClO3 −to→ KCl + O2
Na + H2O → NaOH + H2
H2 + Fe2O3 −to→ Fe + H2O
Mg + HCl → MgCl2 + H2
Hãy chọn hệ số và viết thành phương trình hóa học.
Câu 9: Tìm khối lượng của 1,8.1023 phân tử CO2 và cho biết lượng chất trên chiếm thể tích bao nhiêu ml (đo ở đktc)? (C=12, O=16)
Đáp án và hướng dẫn giải
I. TRẮC NGHIỆM
Câu 1: chọn B
Hướng dẫn: Phương pháp chưng cất dung để tách hai chất lỏng ra khỏi nhau (nhiệt độ sôi khác nhau nhiều).
Câu 2: chọn D
Hướng dẫn: +) Đơn chất là những chất được tạo nên từ 1 nguyên tố hóa học.
+) Hợp chất là những chất được tạo nên từ 2 nguyên tố hóa học trở lên.
Câu 3: chọn C
Câu 4: chọn D
Câu 5: chọn A
Hướng dẫn: +) Từ Fe2O3 → Fe có hóa trị III.
+) Fex(SO4)y. Áp dụng quy tắc hóa trị, ta có:
III.x = II.y → x/y=II/III=2/3
→ CTHH: Fe2(SO4)3.
Câu 6: chọn B
Hướng dẫn: Ta có: nS = 8/32 = 0,25 (mol)
Số nguyên tử Fe = 2 x số nguyên tử S
nFe = 2 x nS = 2 x 0,25 = 0,5 (mol)
MFe = 0,5 x 56 = 28 (gam)
II. TỰ LUẬN
Câu 7:
Gọi t là hóa trị của P trong P2O5
Theo quy tắc hóa trị: 2 x t = 5 x II → t = V
Alx(SO4)y
Theo quy tắc hóa trị: x.III = y.II → x/y = II/III= 2/3
x=2, y=3 → CTHH: Al2(SO4)3
M = 27.2 + (32 + 16.4).3 = 342 (gam)
Câu 8:
4Al + 3O2 −to→ 2Al2O3
P2O5 + 3H2O → 2H3PO4
2KClO3 −to→ 2KCl + 3O2 ↑
Na + H2O → NaOH + 1/2 H2 ↑
3H2 + Fe2O3 −to→ 2Fe + 3H2O
Mg + 2HCl → MgCl2 + H2 ↑
Câu 9: Ta có: nCO2= (1,8.1023)/(6.1023) = 0,3 (mol)
mCO2=0,3 x 44=13,2 (gam)
Và VCO2= 0,3 x 22,4 = 6,72 (lit) = 6720 (ml)
Đề thi hóa 8 học kì 1 (Đề 3)
I. TRẮC NGHIỆM
Học sinh hãy chọn và khoanh tròn câu trả lời đúng nhất cho các câu hỏi sau:
Câu 1: Ở trạng thái bình thường, nguyên tử trung hòa về điện vì:
A. số p = số n
B. số n = số e
C. số e = số p
D. tất cả đều đúng
Câu 2: Công thức hóa học nào sau đây viết đúng?
A. NaO2
B. CO3
C. AgO
D. Al2O3
Câu 3: Khi thổi hơi thở nhẹ vào ống nghiệm đựng nước vôi trong, hiện tượng quan sát được là:
A. sủi bọt khí
B. nước vôi trong bị đục
C. nước vôi trong vẫn trong suốt
D. nước vôi trong chuyển sang màu hồng
Câu 4: Phương trình hóa học dung để biểu diễn ngắn gọn:
A. một phân tử
B. kí hiệu hóa học
C. công thức hóa học
D. phản ứng hóa học
Câu 5: Hai chất khí khác nhau có cùng 1 mol, được đo ở cùng điều kiên nhiệt độ và áp suất như nhau thì thể tích của hai chất khí này như thế nào?
A. bằng nhau
B. bằng nhau và bằng 22,4 lít
C. khác nhau
D. không thể xác định được
Câu 6: Công thức hóa học của một chất cho ta biết:
A. Phân tử khối của chất.
B. Các nguyên tố cấu tạo nên chất.
C. Số nguyên tử của mỗi nguyên tố có trong một phân tử chất.
D. Tất cả đều đúng.
Câu 7: Phân tử khối của canxi cacbonat CaCO3 và sắt(III) sunfat Fe2(SO4)3 lần lượt là:
A. 197 và 342
B. 100 và 400
C. 197 và 234
D. 400 và 100
II. PHẦN TỰ LUẬN
Câu 1: Chọn những từ hoặc cụm từ thích hợp điền vào chỗ trống:
_____ là quá trình biến đổi chất này thành chất khác. Chất biến đổi trong phản ứng gọi là _____, còn _____ mới sinh ra gọi là _____. Trong úa trình phản ứng, lượng chất _____ giảm dần, còn lượng chất_____ tang dần.
Câu 2: Tính khối lượng của:
0,15 mol CuSO4 (Cho Cu=64, S=32, O=16)
5,6 lít khí CO2 (đktc) (Cho C=12, O=16)
Câu 3: Hãy lập các phương trình hóa học sau đây:
Fe + Cl2 −to→ FeCl3
P2O5 + H2O → H3PO4
CO2 + KOH → K2CO3 + H2O
Al2O3 + HCl → AlCl3 + H2O
Câu 4: Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro.
Lập công thức hóa học của muối kẽm clorua. Biết kẽm clorua do hai nguyên tố là Zn và Cl tạo ra.
Tính khối lượng muối kẽm clorua tạo thành.
Đề thi hóa 8 học kì 1 (Đề 3) Đáp án và hướng dẫn giải
I. TRẮC NGHIỆM
Câu 1: chọn C
Hướng dẫn: Số proton mang điện dương và số electron mang điện âm.
Câu 2: chọn D
Hướng dẫn: Áp dụng quy tắc hóa trị để suy ra công thức đúng.
Câu 3: chọn B
Hướng dẫn: Trong hơi thở có khí CO2 nên làm đục nước vôi trong theo phản ứng:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Câu 4: chọn D
Câu 5: chọn A
Hướng dẫn: Các khí khác nhau được ở cùng điều kiện về: nhiệt độ và áp suất thì có cùng số mol => thể tích bằng nhau.
Câu 6: chọn D
Câu 7: chọn B
Hướng dẫn: +) CaCO3 : 40 + 12 + 16 x 3 = 100 đvC
+) Fe2(SO4)3 : 56 x 2 + (32 + 16 x 4) x 3 = 400 đvC
II. TỰ LUẬN
Câu 1:
Phản ứng hóa học là quá trình biến đổi chất này thành chất khác. Chất biến đổi trong phản ứng gọi là chất phản ứng, còn chất mới sinh ra gọi là sản phẩm. Trong quá trinh phản ứng, lượng chất phản ứng giảm dần, còn lượng chất sản phẩm tang dần.
a) Khối lượng của CuSO4: m = n.M = 0,15.160 = 24 (gam)
b) Số mol CO2: n =V/22,4= 5,6/22,4 = 0,25 (mol)
Khối lượng của CO2: m = n.M = 0,25.44 = 11 (gam)
Câu 2: Các phương trình hóa học :
2Fe + 3Cl2 −to→ 2FeCl3
P2O5 + 3H2O → 2H3PO4
CO2 + 2KOH → K2CO3 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Câu 3:
a) Lập công thức hóa học của muối kẽm clorua: ZnCl2
b) Khối lượng muối ZnCl2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)
Đề thi hóa 8 học kì 1 (Đề 4)
I. TRẮC NGHIỆM
Khoanh tròn chữ cái cho câu trả lời.
Câu 1: Trong công thức hóa học nào dưới đây sắt có hóa trị III?
A. FeO
B. Fe2O3
C. Fe3O4
D. FeO hoặc Fe3O4
Câu 2: Hiện tượng nào sau đây là biến đổi hóa học?
A. Nước đá tan chảy
B. Muối ăn tan trong nước tạo thành nước muối
C. Cồn để trong lọ không kín bị bay hơi
D. Sắt bị gỉ sét tạo thành sắt oxit
Câu 3: Ở cùng một điều kiện về nhiệt độ và áp suất, số mol bất kì chất khí nào cũng có thể tích:
A. bằng nhau
B. 22 lít
C. 22,4 lít
D. 24 lít
Câu 4: Hợp chất là những chất tạo nên:
A. từ một chất duuy nhất
B. từ một nguyên tố hóa học
C. từ nhiều chất khác nhau
D. từ hơn một nguyên tố hóa học
Câu 5: Trong công thức hóa học của hidro sunfat H2S và khí sunfurơ SO2, hóa trị của lưu huỳnh lần lượt là:
A. I và II
B. II và IV
C. IV và II
D. đều là II
Câu 6: Dãy nguyên tố hóa học nào dưới đây đều là kim loại?
A. Fe, Cu, Al
B. Fe, S, Cu
C. Fe, C, Al
D. Fe, Cu, H
II. TỰ LUẬN
Câu 1: Chọn hệ số thích hợp để cân bằng các phản ứng háo học sau:
Na + Cl2 −to→ NaCl
SO2 + O2 −to→ SO3
Fe + HCl → FeCl2 + H2
Al(OH)3 −to→ Al2O3 + H2O
Câu 2: Tính số mol trong các hợp chất sau:
8 gam đồng oxit (CuO).
300 gam sắt (III) sunfat (Fe2(SO4)3).
Ở điều kiện tiêu chuẩn, hãy tính thể tích của:
2 mol khí hidro.
16 gam khí oxi.
Cho biết nguyên tử khối của một số nguyên tố hóa học:
S=32, O=16, Cu=64, Fe=56.
Câu 3: Áp dụng công thức tính tỉ khối, hãy tính:
Tỉ khối của khí oxi (O2) đối với khí hidro (H2).
Khối lượng mol khí A có tỉ khối đối với không khí là 2,207.
Câu 4: Đốt cháy 24 gam magie (Mg) với oxi (O2) trong không khí thu được 40 gam magie oxit (MgO). Phản ứng hóa học có phương trinh chữ như sau:
Magie + oxi → magie oxit
Lập phương trình hóa học và viết công thức về khối lượng của phản ứng xảy ra.
Tính khối lượng khí oxi đã phản ứng
Đề thi hóa 8 học kì 1 (Đề 4) Đáp án và hướng dẫn giải
I. TRẮC NGHIỆM
Câu 1: chọn B
Hướng dẫn: +) FeO : a x 1 = II x 1 → a = II (loại)
+) Fe2O3 : b x 2 = II x 3 → b = III (nhận)
+) Fe3O4 : c x 3 = II x 4 → c = 8/3 (loại)
Câu 2: chọn D
Hướng dẫn: Quá trình biễn đổi chất này thành chất khác gọi là hiện tượng hóa học.
Câu 3: chọn A
Câu 4: chọn D
Hướng dẫn: Hợp chất là những chất tạo nên từ hai nguyên tố hóa học trở lên.
Câu 5: chọn B
Hướng dẫn: +) Trong H2S: I x 2 = a x 1 → a = II
+) SO2: b x 1 = II x 2 → b = IV
Câu 6: chọn A
II. TỰ LUẬN
Câu 1: Cân bằng các phản ứng hóa học:
2Na + Cl2 −to→ 2NaCl
2SO2 + O2 −to→ 2SO3
Fe + 2HCl → FeCl2 + H2↑
2Al(OH)3 −to→ Al2O3 + 3H2O
Câu 2: Tính số mol trong các lượng chất:
8 gam đồng oxit: n = m/M= 8/80 = 0,1 (mol)
300 gam Fe2(SO4)3: n = m/M= 300/400 = 0,75 (mol)
2 mol khí hidro: V = n.22,4 = 2.22,4 = 44,8 (lít)
16 gam khí oxi: n = m : M = 16 : 32 = 0,5 (mol)
V = n.22,4 = 0,5.22,4 = 11,2 (lít)
Câu 3: Áp dụng công thức tính tỉ khối, ta có:
Tỉ khối của khí oxi (O2) đối với khí hidro (H2):
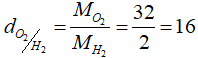
Khối lượng mol khí A có tỉ khối với không khí là 2,207:
dA/kk = MA/29 → MA = d.29 = 2,207.29 = 64 (gam)
Câu 4:
Lập phương trình hóa học và viết công thức về khối lượng của các chất trong phản ứng: 2Mg + O2 → 2MgO
mMg+ mO2= mMgO
Khối lượng oxi phản ứng: mO2= mMgO– mMg= 40 – 24 = 16 (gam)
Đề thi hóa 8 học kì 1 (Đề 5)
I. TRẮC NGHIỆM
Hãy khhoanh tròn một trong các chữ A, B, C, D trước phương án chọn đúng.
Câu 1: Hãy chọn câu phát biểu đúng.
A. Nguên tử là những hạt vô cùng nhỏ gồm proton mang điện tích dương và các electron mang điện tích âm.
B. Nguyên tử là những hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử tạo bởi các electron mang điện tích âm.
C. Hạt nhân nguyên tử gồm các hạt proton, nowtron, electron.
D. Trong mỗi nguyên tử số proton bằng số electron cộng với số nowtron.
Câu 2: Cho các chất có công thức hóa học như sau:
1. O2 2. O3 3. CO2 4. Fe2O3 5. SO2 6. N2 7. H2O
Nhóm chỉ gồm các hợp chất là:
A. 1, 3, 5, 7
B. 2, 4, 6, 5
C. 2, 3, 5, 6
D. 3, 4, 5, 7
Câu 3: Một bình chứa hỗn hợp khí X gồm 1,12 lít khí oxi và 2,24 lít khí cacbon đioxit ở đktc. Tổng số mol các khí trong hỗn hợp khí X là:
A. 0,25
B. 0,5
C. 0,15
D. 0,20
Câu 4: Công thức hóa học hợp chất của nguyên tố X với nhóm SO4 có hóa trị II là X2(SO4)3. Công thức hóa học hợp chất của nguyên tố Y với hidro là H3Y.
Công thức hóa học hợp chất của nguyên tố X và nguyên tố Y là:
A. XY2
B. XY3
C. XY
D. X2Y3
Câu 5: Đốt cháy hoàn toàn 12,8 gam đồng (Cu) trong bình chứa oxi (O2) thu được 16 gam đồng (II) oxit (CuO). Khối lượng oxi đã tham gia phản ứng là:
A. 6,4 gam
B. 4,8 gam
C. 3,2 gam
D. 1,67 gam
Câu 6: Khối lượng của 0,5 mol Mg và 0,3 mol CO2 tương ứng là:
A. 10 gam Mg; 12 gam CO2
B. 13 gam Mg; 15 gam CO2
C. 12 gam Mg; 13,2 gam CO2
D. 14 gam Mg; 14,5 gam CO2
(Cho Mg = 24; O = 16; C = 12).
Câu 7: Hãy điền các hệ số vào trước các công thức hóa học của các chất thích hợp để được các phương trình hóa học đúng.
___Al + ___H2SO4 → Al2(SO4)3 + ___H2
A. 2, 3, 1, 3
B. 3, 2, 1, 3
C. 2, 2, 1, 3
D. 2, 3, 3, 1
Câu 8: Thể tích hỗn hợp khí gồm 0,5 mol CO2 và 0,2 mol O2 ở điều kiện tiêu chuẩn là:
A. 11,2 lít
B. 22,4 lít
C. 4,48 lít
D. 15,68 lít
II. TỰ LUẬN
Câu 9:
1) Tính khối lượng của hỗn hợp khí ở đktc gồm 2,24 lít SO2 và 3,36 lít O2.
2) Tính thể tích ở đktc của một hỗn hợp khí gồm 4,4 gam CO2 và 3,2 gam O2.
3) Tính số mol chứa trong 3.1023 phân tử nước.
Câu 10: Phản ứng hóa học xảy ra khi cồn cháy (đèn cồn trong phòng thí nghiệm) là
Rượu etylic (C2H5OH) + oxi cacbonic (CO2) + nước
1) Hãy lập phương trình hóa học của phản ứng.
2) Cho biết tỉ lệ số phân tử của các chất trong phản ứng hóa học.
3) Tính tỉ lệ về khối lượng giữa các chất trong phản ứng hóa học.
4) Tính thể tích khí oxi cần thiết để đốt cháy hết 4,6 gam rượu etylic và thể tích khí cacbonic tạo thành ở điều kiện tiêu chuẩn.
Đề thi hóa 8 học kì 1 (Đề 5) Đáp án và hướng dẫn giải
I. TRẮC NGHIỆM
Câu 1: chọn B
Câu 2: chọn D
Câu 3: chọn C
Hướng dẫn: nO2= 1,12/22,4 = 0,05 (mol)
nCO2= 2,24/22,4 = 0,1 (mol)
nhhX = nO2+ nCO2= 0,05 + 0,1 = 0,15 (mol)
Câu 4: chọn C
Hướng dẫn: * X2(SO4)3 : a x 2 = II x 3 → a = III
* H3Y : I x 3 = b x 1 → b = III → CTHH: XY
Câu 5: chọn C
Hướng dẫn: Áp dụng ĐLBTKL, ta có:
mCu+ mO2= mCuO→ mO2= mCuO– mCu= 16 – 12,8 = 3,2 (gam)
Câu 6: chọn C
Hướng dẫn: +) mMg = 0,5.24 = 12 (gam)
+) mCO2= 0,3.44 = 13,2 (gam)
Câu 7: Hướng dẫn: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑. Chọn A
Câu 8: chọn D
Hướng dẫn: Vhh = (0,5+0,2) x 22,4 = 15,68 (lít)
II. TỰ LUẬN
Câu 9:
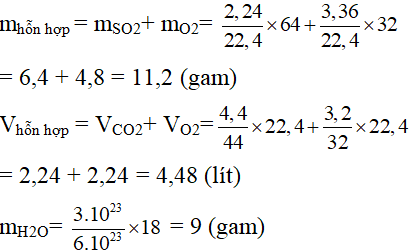
Câu 10:
C2H5OH + 3O2 −to→ 2CO2 + 3H2O (1)
Tỉ lệ số phân tử C2H5OH: số phân tử O2: số phân tử CO2: số phân tử H2O = 1 : 3 : 2 : 3
mC2H5OH ∶ mO2 ∶ mCO: mH2O = 46 : (3×32) : (2×44) : (3×18)
= 46 : 96 : 88 : 54
Ta có : nC2H5OH= 4,6/46 = 0,1 (mol)
Từ (1) → nCO2=0,2 (mol) → VCO2= 0,2.22,4 = 4,48 (lít)
Từ (1) → nO2= 0,3 (mol) → VO2= 0,3.22,3 = 6,72 (lít)
Giải đề thi học kì 1 hoá lớp 8 năm 2019 – 2020 PGD quận Bình Thạnh
Giải chi tiết đề thi học kì 1 môn hoá lớp 8 năm 2019 – 2020 PGD quận Bình Thạnh với cách giải nhanh và chú ý quan trọng
Câu 1 (2 điểm):
1.1 Xét công thức hóa học của axit photphoric H3PO4. Xác định các nguyên tố cấu tạo nên chất, số nguyên tử của mỗi nguyên tố. Tính phân tủ khối của axit photphoric.
1.2 Cho công thức hóa học của X và H là XH của Y và O là YO. Lập công thức hóa học giữa X và Y.
Câu 2 (2 điểm):
Xét các quá trình dưới đây, hiện tượng nào là hiện tượng hóa học, hiện tượng nào là hiện tượng vật lý. Giải thích.
a. Sắt để ngoài không khí lâu ngày bị gỉ sét (oxit sắt từ).
b. Xăng để trong bình không đậy nắp bị bay hơi.
c. Khi nhiệt độ nóng dần lên, băng ở hai cực tan ra.
d. Trong lò nung đá vôi, canxi cacbonat chuyển dần thành vôi sống (canxi oxit) và khí cacbon đioxit thoát ra ngoài.
Câu 3 (3 điểm):
Hoàn thành các phương trình hóa học sau:
a. K+O2→K2OK+O2→K2O
b. Fe+O2→Fe3O4Fe+O2→Fe3O4
c. Al+Cl2→AlCl3Al+Cl2→AlCl3
d. P2O5+H2O→H3PO4P2O5+H2O→H3PO4
e. H2+Fe3O4→Fe+H2OH2+Fe3O4→Fe+H2O
f. KClO3→KCl+O2KClO3→KCl+O2
Câu 4 (1 điểm):
Trình bày phương pháp làm sạch đường ăn có lẫn cát.
Câu 5 (2 điểm):
Một thanh magie nặng 240 gam để ngoài không khí bị khí oxi phản ứng tạo thành magie oxit. Đem cân thanh này bị nặng 272 gam.
a. Viết phương trình và cân bằng phương trình phản ứng.
b. Tính thể tích (đktc) khí oxi đã tham gia phản ứng.
(Cho H = 1; P = 31; O = 16)
HƯỚNG DẪN GIẢI CHI TIẾT
Câu 1 (TH):
Phương pháp:
1.1 Mỗi công thức hóa học chỉ 1 phân tử của chất, cho biết
– Nguyên tố nào tạo ra chất.
– Số nguyên tử của mỗi nguyên tố trong một phân tử chất.
– Phân tử khối của chất.
1.2
– Một nguyên tử của nguyên tố khác liên kết với bao nhiêu nguyên tử hiđro thì nói nguyên tố đó có hóa trị bằng bấy nhiêu.
– Hóa trị của O bằng 2 đơn vị, Oxi có hóa trị II.
– Lập công thức hóa học của hợp chất theo hóa trị
+ Viết công thức dạng chung AxBy
+ Áp dụng quy tắc về hóa trị: x.a = y.b với a, b lần lượt là hóa trị của nguyên tố A và B
+ Chuyển thành tỷ lệ x/y=b/a=b′/a′
+ Lấy x = b (hoặc x = b’) và y = a (hoặc y = a’) nếu a’, b’ là những số nguyên đơn giản hơn so với a và b
+ Viết thành công thức hóa học.
Cách giải:
1.1 Từ công thức hóa học của axit photphoric H3PO4, ta biết được:
– Hợp chất được tạo bởi các nguyên tố Hiđro, Photpho, Oxi
– Có 3 nguyên tử Hiđro, 1 nguyên tử Photpho, 4 nguyên tử Oxi tạo thành phân tử.
– Phân tử khối = 1.3 + 31.1 + 16.4 = 98 đvC.
1.2
– Vì X liên kết với 1 nguyên tử H nên X có hóa trị I
– Vì Y liên kết với 1 nguyên tử O nên Y có hóa trị II.
– Gọi công thức giữa X và Y là XxYy
Áp dụng quy tắc hóa trị: x.I = y.II
→x/y=2/1
Lấy x = 2 và y = 1
Vậy công thức hóa học giữa X và Y là X2Y.
Câu 2 (TH):
Phương pháp:
– Hiện tượng vật lý: là hiện tượng chỉ biến đổi về trạng thái, hình dạng nhưng vẫn giữ nguyên là chất ban đầu.
– Hiện tượng hóa học: là hiện tượng khi có sự biến đồi chất này thành chất khác.
Cách giải:
a. Sắt để ngoài không khí lâu ngày bị gỉ sét (oxit sắt từ)
® đây là hiện tượng hóa học do sắt tác dụng với oxi trong không khí tạo thành oxit sắt từ.
b. Xăng để trong bình không đậy nắp bị bay hơi.
® đây là hiện tượng vật lý do xăng chỉ chuyển trạng thái từ dạng lỏng sang dạng hơi mà không bị biến đổi thành chất khác.
c. Khi nhiệt độ nóng dần lên, băng ở hai cực tan ra.
® đây là hiện tượng vật lý do băng tan chỉ là chuyển từ trạng thái rắn sang trạng thái lỏng mà không bị biến đổi thành chất khác.
d. Trong lò nung đá vôi, canxi cacbonat chuyển dần thành vôi sống (canxi oxit) và khí cacbon đioxit thoát ra ngoài.
® đây là hiện tượng hóa học do canxi cacbonat bị biến đổi thành canxi oxit và khí cacbon đioxit.
Câu 3 (TH):
Phương pháp:
Các bước lập phương trình hóa học
+ Bước 1: Viết sơ đồ phản ứng, gồm công thức hóa học của chất tham gia, sản phẩm.
+ Bước 2: Cân bằng số nguyên tử mỗi nguyên tố: tìm hệ số thích hợp đặt trước các công thức sao cho số nguyên tử các nguyên tố ở chất tham gia và chất tạo thành là bằng nhau.
+ Bước 3: Viết thành phương trình hóa học.
Cách giải:
a. 4K+O2→2K2O4K+O2→2K2O
b. 3Fe+2O2→Fe3O43Fe+2O2→Fe3O4
c. 2Al+3Cl2→2AlCl32Al+3Cl2→2AlCl3
d. P2O5+3H2O→2H3PO4P2O5+3H2O→2H3PO4
e. 4H2+Fe3O4→3Fe+4H2O4H2+Fe3O4→3Fe+4H2O
f. 2KClO3→2KCl+3O22KClO3→2KCl+3O2
Câu 4 (VD):
Phương pháp:
a. Viết PTHH và cân bằng.
b.
– Áp dụng bảo toàn khối lượng cho phản ứng, tính khối lượng của Oxi
– Áp dụng công thức n=m/Mn, tính số mol oxi
Cách giải:
a. 2Mg+O2(t0)→2MgO
b. Áp dụng bảo toàn khối lượng cho phản ứng: mMg+mO2=mMgOmMg+mO2=mMgO
→mO2=mMgO−mMg=272−240=32gam
→nO2=32/32=1mol
→VO2=1.22,4=22,4lit
Đề số 1 – Đề kiểm tra học kì 1 – Hóa học 8
Đề bài
Phần trắc nghiệm 4 điểm)
Câu 1. Hãy điền vào chỗ trống những từ hay cụm từ thích hợp sao cho đúng với nội dung các định nghĩa, định luật sau:
a) Một mol của bất kì chất…………………. nào ở……………………………. điều kiện nhiệt
độ và áp suất đều chiếm những thể tích bằng nhau.
b) Phân tử là……………………. đại diện cho chất gồm………………………………….. liên kết
với nhau và thể hiện đầy đủ tính chất hoá học của chất.
c) Trong một phản ứng hoá học,…………………………………….. của
sản phẩm…………………………. tổng khối lượng các chất tham gia.
d) Nguyên tố hoá học là tập hợp………………………………… có cùng…………………………
Câu 2. Dãy các công thức hoá học nào sau đây viết đúng?
A. H2O, CO3, NaCl, HCl, CaS.
B. H2O, CO2, Al2O, Na2SO4, CaS2.
C. HCl, H2O, CO2, Al2O3, H2SO4.
D. HCl, C02, NaCl2, NaS04,CaS.
Câu 3. Khí A nặng hơn khí hiđro 14 lần và là khí độc. Khí A là
A. CO2. B. N2. C.CO. D. SO2.
Câu 4. Cho các chất sau:
a) Cát sạch. b) Bột nhôm. c) Muối ăn. d) Vôi sống.
e) Cồn C2H6O. g) Khí hiđro. h) Bột sắt
Nhóm các chất đều gồm các đơn chất là
A.a, b, c. B. b, g, h.
C. b, g, c. D. a, e, b.
Phần tự luận (6 điểm)
Câu 1. (2 điểm) a) Tính thể tích ở đktc của một hỗn hợp khí gồm 1,1 gam CO2 và 2,8 gam CO.
b) 0,25 mol hợp chất A2O có khối lượng 15,5 gam. Tìm CTHH của hợp chất
c) Hợp chất khí NOx có tỷ khối với hiđro là 23. Tìm CTHH của hợp chất.
Câu 2. (2 điểm) Điền hệ số thích hợp để hoàn thành các phương trình hoá học sau:
Fe + Cu →→ FeCl3
Al(OH)3 →→ Al2O3 +H2O.
Ca(OH)2+ H3PO4 →→ Ca3(PO4)2 + H2O
ZnS + O2 →→ ZnO + SO2
Câu 3. (2 điểm) Cho 6,5 gam kim loại X hoá trị II tác dụng hoàn toàn với khí oxi (đktc), sau phản ứng thu được 8,1 gam muối XO. Hỏi:
a) Viết PTHH.
b) Tính thể tích khí oxi (đktc) đã phản ứng với kim loại X.
c) Tìm kim loại X.
(Biết: C = 12 ; N = 14 ; s = 32 ; Na = 23 ; C1 = 35,5 ; Zn = 65 ; O = 16.)
Đề số 1 – Đề kiểm tra học kì 1 – Hóa học 8
Phần trắc nghiệm (4 điểm)
Trả lời đúng mỗi câu được 1,0 điểm
Câu 1.
a) Một mol của bất kì chấtkhí nào ở cùng điều kiện nhiệt độ và áp suất đều chiếm những thể tích bằng nhau.
b) Phân tử là hạt đại diện cho chất gồm một số nguyên tử liên kết với nhau và thê hiện đầy đủ tính chất hoá học của chất.
c) Trong một phản ứng hoá học, tổng khôi lượng của sản phẩm bằng tổng khối lượng các chất tham gia.
d) Nguyên tố hoá học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân
Câu 2. C
Câu 3. C Câu 4. B.
Phần tự luận (6 điểm)
Câu 1. (2 điểm)
a) Thể tích của hỗn hợp là
Vhh=22,4.(1,1/44+2,8/28)=2,8(l)
M=15,5/0,25=62
⇒2A+16=62⇒A=23.
b) Nguyên tố Na ⇒⇒ Na2O
c) M=23.2=46⇒14+16x=46M=23.2=46⇒14+16x=46
⇒x=2⇒NO2⇒x=2⇒NO2
Câu 2. (2 điểm)
2Fe+3Cl2to⟶2FeCl32Al(OH)3to⟶Al2O3+3H2O3Ca(OH)2+2H3PO4→Ca3(PO4)2+6H2O2ZnS+3O2to⟶2ZnO+2SO22Fe+3Cl2⟶to2FeCl32Al(OH)3⟶toAl2O3+3H2O3Ca(OH)2+2H3PO4→Ca3(PO4)2+6H2O2ZnS+3O2⟶to2ZnO+2SO2
Câu 3. (2 điểm)
a)
2X+O2(to)⟶2XO2X+O2⟶(to)2XO
b ) Áp dụng định luật bảo toàn khối lượng
⇒mO2=1,6(gam)⇒VO2=1,12⇒mO2=1,6(gam)⇒VO2=1,12 (lít).
b) Ta có 2nO2=nX=0,1⇒M=65(Zn).
Đề số 2 – Đề kiểm tra học kì 1 – Hóa học 8
Đề bài
Phần trắc nghiệm (3 điểm)
Câu 1. Hãy chọn từ, cụm từ thích hợp có liên quan đến khái niệm mol để điền vào chỗ trống trong các câu sau đây:
a)……………………………. ……là lượng chất có chứa N ……………hoặc N ………………
b)Khối lượng của 0,1 mol NaCl là khối lượng của………… phân tử chất đó
tính ra gam, có số trị bằng……………………
c) Ở đktc thể tích của 6,4 gam khí oxi là…………….(lít).
Câu 2. Oxit của kim loại A có công thức hoá học là A2O3,còn công thức hoá học của axit nitric là HNO3. Công thức hoá học của muối nitrat nào dưới đây của A là đúng?
A. ANO3. B. A(N03)2.
C.A(NO3)3. D. A2NO3.
Phân tử khối của muối nitrat đó là 213. Vậy A là kim loại………………………………….
Câu 3. Hai chất khí có thể tích bằng nhau khi:
A. Số phân tử bằng nhau.
B. Số mol bằng nhau trong cùng điều kiện về nhiệt độ và áp suất.
C. Khối lượng bằng nhau.
D. Cả 3 ý kiến trên đều đúng.
Phần tự luận (7 điểm)
Câu 1. (2 điểm) Hãy xác định khối lượng và thế tích (đktc) của những hỗn hợp khí sau đây:
a) 0,5 N phân tử oxi + 2,5 N phân tử CO2 + 0,25 N phân tử nitơ.
b) 6.1023 phân tử hiđro+ 1.5.1023 phân tửnitơ + 3.1023 phân tử NH3.
Câu 2. (1 điểm)
a) 0,5 mol A203 có khối lượng là 80 gam. Tìm CTHH của hợp chất.
a) Hợp chất khí NxO có tỉ khối với hiđro là 22. Tìm CTHH của hợp chất.
Câu 3. (2 điểm) Điền hệ số thích hợp để hoàn thành các phương trình hoá học sau đây:
Fe2O3 + HCl →→ FeCl3+ H2O
Na + H2O →→ NaOH + H2
CaO + H3PO4 →→ Ca3(PO4)2 + H2O
C2H6+ O2 →→ CO2 + H2O
Câu 4. (2 điếm) Cho 6,5 gam kim loại X hoá trị II tác dụng hoàn toàn với khí clo (đktc), sau phản ứng thu được 13,6 gam muối XC1?.
a) Viết PTHH.
b) Tính thể tích khí clo (đktc) đã phản ứng với kim loại X.
c) Tìm kim loại X.
(Biết: C = 12 ; N = 14 ; S = 32 ; Na = 23 ; C1 = 35,5 ; Zn = 65 ;
Al = 27)
Đề số 2 – Đề kiểm tra học kì 1 – Hóa học 8 Lời giải chi tiết
Phần trắc nghiệm (3 điểm)
Trả lời đúng mỗi câu được 1 điểm
Câu 1.
a) Mol là lượng chất có chứa N nguyên tử hoặc N phân tử.
b) Khối lượng của 0,1 mol NaCl là khối lượng của ổ. 1022 phân tử chất đó tính ra gam, có số trị bằng 5,85 gam.
c) Ở đktc thể tích của 6,4 gam khí oxi là 4,48 lít.
Câu 2. C.
A là kim loại nhôm Al.
Câu 3. B
Phần tự luận (7 điểm)
Câu 1. (2 điểm)
a) Khối lượng của hỗn hợp:
mhh = 0,5.32 + 2,5.44 + 0,25.28 = 133 (gam).
vhh = (0,5 + 2,5 + 0,25).22,4 = 72,8 (lít).
b) Khối lượng của hỗn hợp :

Câu 4. (2 điểm)
a) X + Cl2to⟶⟶to XCl2
b) Áp dụng định luật bảo toàn khối lượng
⇒mCl2=13,6−6,5=7,1⇒mCl2=13,6−6,5=7,1 (gam).
⇒VCl2=.22,4=2,24⇒VCl2=.22,4=2,24 (lít).
b) Ta có nx = 0,1 (mol)
⇒⇒ X=6,50,1=65
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/de-thi-mon-hoa-hoc-ki-1-lop-8/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





