Hóa 10 bài 4: Cấu tạo vỏ nguyên tử, phân lớp Electron và bài tập vận dụng. Các electron trong nguyên tử chuyển động rất nhanh với tốc độ hàng nghìn km/s trong khu vực xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên tử.
Vậy cấu tạo vỏ nguyên tử ra sao? phân lớp electron là gì? thế nào là phân lớp electron bão hòa? chúng ta cùng tìm hiểu chi tiết qua bài viết dưới đây.
Bạn đang xem bài: Hóa 10 bài 4: Cấu tạo vỏ nguyên tử, phân lớp Electron và bài tập vận dụng
I. Sự chuyển động của các Electron trong nguyên tử
– Các electron chuyển động rất nhanh trong khu vực xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên tử.
– Trong nguyên tử thì số electron (e) = số proton (p) = số hiệu nguyên tử (Z): e = p = Z.
II. Lớp Electron và phân lớp Electron
1. Lớp Electron
– Ở trạng thái cơ bản, các electron lần lượt chiếm các mức năng lượng từ thấp đến cao (từ gần hạt nhân ra xa hạt nhân) và sắp xếp thành từng lớp.
– Các electron ở gần nhân liên kết bền hơn với hạt nhân. Vậy electron ở lớp trong có mức năng lượng thấp hơn so với ở các lớp ngoài.
– Các electron trên cùng 1 lớp có mức năng lượng gần bằng nhau
– Xếp theo thứ tự mức năng lượng từ thấp đến cao, các lớp e này được ghi bằng các số nguyên tử theo thứ tự n= 1, 2, 3, 4,… với tên gọi : K, L, M, N,…
2. Phân lớp Electron
– Các e trên cùng một phân lớp có mức năng lượng bằng nhau.
– Các phân lớp được kí hiệu bằng chữ cái thường: s, p, d, f.
– Các electron ở phân lớp s gọi là electron s, electron ở phân lớp p gọi là electron p,…
* Ví dụ:
+ Lớp thứ nhất (lớp K, n = 1) có 1 phân lớp s
+ Lớp thứ hai (lớp L, n = 2) có 2 phân lớp s, p
+ Lớp thứ ba (lớp M, n = 3) có 1 phân lớp s, p, d
+ Lớp thứ bốn (lớp N, n = 4) có 2 phân lớp s, p, d, f
3. Obitan nguyên tử
– Obitan nguyên tử là khu vực không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất (90%).
– Ký hiệu Obitan: AO
– Trên 1 AO chỉ chứa tối đa 2 electron được gọi là electron ghép đôi.
– Nếu trong 1 AO chứa 1 electron thì được gọi là e độc thân.
– Nếu trong AO không chứa electron nào được gọi là AO trống.
– Phân lớp s có 1 AO hình cầu
– Phân lớp p có 3 AO hình số 8 nổi
– Phân lớp d có 5 AO và phân lớp f có 7 AO hình dạng phức tạp
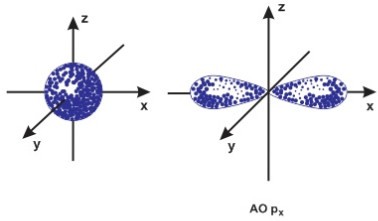
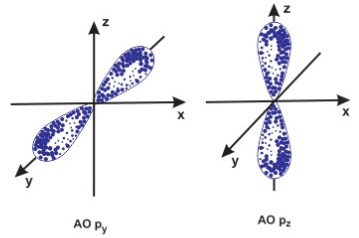 Hình dạng obitan s và p.
Hình dạng obitan s và p.
III. Số electron tối đa trong một phân lớp, một lớp
1. Số electron tối đa trong một phân lớp, phân lớp electron bão hòa.
• Nguyên lý Pauli
– Trên 1 Obitan nguyên tử chứa tối đa 2 electron và có chiều tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
* Ví dụ: phân lớp s chứa 1 AO ⇒ số e tối đa trong phân lớp s = 2.1 = 2.
| Số e tối đa = 2 x số AO | Cách ghi | |
| Phân lớp s | 2.1=2 | s2 |
| Phân lớp p | 2.3=6 | p6 |
| Phân lớp d | 2.5=10 | d10 |
| Phân lớp f | 2.7=14 | f14 |
• Phân lớp Electron bão hòa.
– Phân lớp đã đủ số electron tối đa gọi là phân lớp electron bão hòa
2. Số Electron tối đa trong 1 phân lớp, lớp electron bão hòa
– Lớp electron đã đủ số e tối đa được gọi là lớp electron bão hòa
– Lớp electron bão hòa khi các phân lớp electron trong lớp đó bão hòa
| Thứ tự | Số phân lớp | Số e tối đa (2.n2) | |
| Lớp K | n=1 | 1s | 2e |
| Lớp L | n=2 | 2s 2p | 8e |
| Lớp M | n=3 | 3s 3p 3d | 18e |
| Lớp N | n=4 | 4s 4p 4d 4f | 32e |
III. Bài tập về cấu tạo vỏ nguyên tử và phân lớp electron
* Bài 1 trang 22 SGK Hóa 10: Một nguyên tử M có 75 electron và 110 nơtron. Kí hiệu của nguyên tử M là:
A. 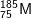 B.
B.  C.
C.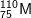 D.
D.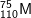
Chọn đáp án đúng.
° Lời giải bài 1 trang 22 SGK Hóa 10:
– A đúng. Z = 75, số khối A = 75 + 110 = 185
* Bài 2 trang 22 SGK Hóa 10: Nguyên tử nào trong các nguyên tử sau đây chứa đồng thời 20 notron, 19 proton và 19 electron?
A. 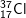 B.
B.  C.
C. 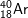 D.
D. 
° Lời giải bài 2 trang 22 SGK Hóa 10:
– Đáp án đung: B.
– Hạt chứa 20 notron và 19 proton và 19 electron. Suy ra Z = 19, số khối A = 19 + 20 = 39.
* Bài 3 trang 22 SGK Hóa 10: Số đơn vị điện tích hạt nhân của nguyên tử flo là 9. Trong nguyên tử flo, số electron ở mức năng lượng cao nhất là:
A. 2. B. 5. C. 9. D. 11.
° Lời giải bài 3 trang 22 SGK Hóa 10:
– Đáp án đúng: B. 5
– Số đơn vị điện tích hạt nhân của nguyên tử flo là 9, suy ra flo có 9 electron phân bố vào các phân lớp như sau: 1s22s22p5. Vậy flo có 5 electron ở mức năng lượng cao nhất.
* Bài 4 trang 22 SGK Hóa 10: Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử X là:
A. 6 B. 8 C. 14 D. 16
Hãy chọn đáp số đúng.
° Lời giải bài 4 trang 22 SGK Hóa 10:
– Đáp án đúng: D. 16
– Các electron của nguyên tử nguyên tố X được phân bố trên 3 mức năng lượng, lớp thứ 3 có 6 electron, như vậy có sự phân bố như sau 1s22s22p63s23p4.
⇒ Số đơn vị điện tích hạt nhân của nguyên tử X là 16+.
* Bài 5 trang 22 SGK Hóa 10: a) Thế nào là lớp và phân lớp electron ? Sự khác nhau giữa lớp và phân lớp electron?
b) Tại sao lớp N chứa tối đa 32 electron.
° Lời giải bài 5 trang 22 SGK Hóa 10:
a) Lớp: Cho biết số nguyên tố trong cùng chu kì.
– Phân lớp: Cho biết số obitan và số electron tối đa trong một phân lớp
– Lớp và phân lớp khác nhau ở điểm: Lớp cho biết số nguyên tố trong chu kì, còn phân lớp cho biết số obitan và số electron tối đa.
b) Lớp N là lớp thứ 4 có các phân lớp s, p, d, f có số electron tối đa tương ứng các phân lớp là 2, 6, 10, 14 ([….]4s24p64d104f14) nên số electron tối đa là 32.
* Bài 6 trang 22 SGK Hóa 10: Nguyên tử agon có kí hiệu là 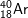
– Hãy xác định số proton, số proton trong hạt nhân và số electron ở vỏ electron của nguyên tử.
– Hãy xác định sự phân bố electron trên các lớp.
° Lời giải bài 6 trang 22 SGK Hóa 10:
– Ta có, Z= 18 suy ra trong hạt nhân Ar có 18p và 22n (40 – 18), lớp vỏ electron của nguyên tử có 18e được phân bố như sau: 1s22s22p63s23p6.
Hy vọng với bài viết về Cấu tạo vỏ nguyên tử, phân lớp Electron, lớp Electron bão hòa và bài tập ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
Xem thêm Hóa 10 bài 4
Hóa 10 bài 4: Cấu tạo vỏ nguyên tử, phân lớp Electron và bài tập vận dụng. Các electron trong nguyên tử chuyển động rất nhanh với tốc độ hàng nghìn km/s trong khu vực xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên tử. Vậy cấu tạo vỏ nguyên tử ra sao? phân lớp electron là gì? thế nào là phân lớp electron bão hòa? chúng ta cùng tìm hiểu chi tiết qua bài viết dưới đây. I. Sự chuyển động của các Electron trong nguyên tử – Các electron chuyển động rất nhanh trong khu vực xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên tử. – Trong nguyên tử thì số electron (e) = số proton (p) = số hiệu nguyên tử (Z): e = p = Z. II. Lớp Electron và phân lớp Electron 1. Lớp Electron – Ở trạng thái cơ bản, các electron lần lượt chiếm các mức năng lượng từ thấp đến cao (từ gần hạt nhân ra xa hạt nhân) và sắp xếp thành từng lớp. – Các electron ở gần nhân liên kết bền hơn với hạt nhân. Vậy electron ở lớp trong có mức năng lượng thấp hơn so với ở các lớp ngoài. – Các electron trên cùng 1 lớp có mức năng lượng gần bằng nhau – Xếp theo thứ tự mức năng lượng từ thấp đến cao, các lớp e này được ghi bằng các số nguyên tử theo thứ tự n= 1, 2, 3, 4,… với tên gọi : K, L, M, N,… 2. Phân lớp Electron – Các e trên cùng một phân lớp có mức năng lượng bằng nhau. – Các phân lớp được kí hiệu bằng chữ cái thường: s, p, d, f. – Các electron ở phân lớp s gọi là electron s, electron ở phân lớp p gọi là electron p,… * Ví dụ: + Lớp thứ nhất (lớp K, n = 1) có 1 phân lớp s + Lớp thứ hai (lớp L, n = 2) có 2 phân lớp s, p + Lớp thứ ba (lớp M, n = 3) có 1 phân lớp s, p, d + Lớp thứ bốn (lớp N, n = 4) có 2 phân lớp s, p, d, f 3. Obitan nguyên tử – Obitan nguyên tử là khu vực không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất (90%). – Ký hiệu Obitan: AO – Trên 1 AO chỉ chứa tối đa 2 electron được gọi là electron ghép đôi. – Nếu trong 1 AO chứa 1 electron thì được gọi là e độc thân. – Nếu trong AO không chứa electron nào được gọi là AO trống. – Phân lớp s có 1 AO hình cầu – Phân lớp p có 3 AO hình số 8 nổi – Phân lớp d có 5 AO và phân lớp f có 7 AO hình dạng phức tạp Hình dạng obitan s và p. III. Số electron tối đa trong một phân lớp, một lớp 1. Số electron tối đa trong một phân lớp, phân lớp electron bão hòa. • Nguyên lý Pauli – Trên 1 Obitan nguyên tử chứa tối đa 2 electron và có chiều tự quay khác chiều nhau xung quanh trục riêng của mỗi electron. * Ví dụ: phân lớp s chứa 1 AO ⇒ số e tối đa trong phân lớp s = 2.1 = 2. Số e tối đa = 2 x số AO Cách ghi Phân lớp s 2.1=2 s2 Phân lớp p 2.3=6 p6 Phân lớp d 2.5=10 d10 Phân lớp f 2.7=14 f14 • Phân lớp Electron bão hòa. – Phân lớp đã đủ số electron tối đa gọi là phân lớp electron bão hòa 2. Số Electron tối đa trong 1 phân lớp, lớp electron bão hòa – Lớp electron đã đủ số e tối đa được gọi là lớp electron bão hòa – Lớp electron bão hòa khi các phân lớp electron trong lớp đó bão hòa Thứ tự Số phân lớp Số e tối đa (2.n2) Lớp K n=1 1s 2e Lớp L n=2 2s 2p 8e Lớp M n=3 3s 3p 3d 18e Lớp N n=4 4s 4p 4d 4f 32e III. Bài tập về cấu tạo vỏ nguyên tử và phân lớp electron * Bài 1 trang 22 SGK Hóa 10: Một nguyên tử M có 75 electron và 110 nơtron. Kí hiệu của nguyên tử M là: A. B. C. D. Chọn đáp án đúng. ° Lời giải bài 1 trang 22 SGK Hóa 10: – A đúng. Z = 75, số khối A = 75 + 110 = 185 * Bài 2 trang 22 SGK Hóa 10: Nguyên tử nào trong các nguyên tử sau đây chứa đồng thời 20 notron, 19 proton và 19 electron? A. B. C. D. ° Lời giải bài 2 trang 22 SGK Hóa 10: – Đáp án đung: B. – Hạt chứa 20 notron và 19 proton và 19 electron. Suy ra Z = 19, số khối A = 19 + 20 = 39. * Bài 3 trang 22 SGK Hóa 10: Số đơn vị điện tích hạt nhân của nguyên tử flo là 9. Trong nguyên tử flo, số electron ở mức năng lượng cao nhất là: A. 2. B. 5. C. 9. D. 11. ° Lời giải bài 3 trang 22 SGK Hóa 10: – Đáp án đúng: B. 5 – Số đơn vị điện tích hạt nhân của nguyên tử flo là 9, suy ra flo có 9 electron phân bố vào các phân lớp như sau: 1s22s22p5. Vậy flo có 5 electron ở mức năng lượng cao nhất. * Bài 4 trang 22 SGK Hóa 10: Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử X là: A. 6 B. 8 C. 14 D. 16 Hãy chọn đáp số đúng. ° Lời giải bài 4 trang 22 SGK Hóa 10: – Đáp án đúng: D. 16 – Các electron của nguyên tử nguyên tố X được phân bố trên 3 mức năng lượng, lớp thứ 3 có 6 electron, như vậy có sự phân bố như sau 1s22s22p63s23p4. ⇒ Số đơn vị điện tích hạt nhân của nguyên tử X là 16+. * Bài 5 trang 22 SGK Hóa 10: a) Thế nào là lớp và phân lớp electron ? Sự khác nhau giữa lớp và phân lớp electron? b) Tại sao lớp N chứa tối đa 32 electron. ° Lời giải bài 5 trang 22 SGK Hóa 10: a) Lớp: Cho biết số nguyên tố trong cùng chu kì. – Phân lớp: Cho biết số obitan và số electron tối đa trong một phân lớp – Lớp và phân lớp khác nhau ở điểm: Lớp cho biết số nguyên tố trong chu kì, còn phân lớp cho biết số obitan và số electron tối đa. b) Lớp N là lớp thứ 4 có các phân lớp s, p, d, f có số electron tối đa tương ứng các phân lớp là 2, 6, 10, 14 ([….]4s24p64d104f14) nên số electron tối đa là 32. * Bài 6 trang 22 SGK Hóa 10: Nguyên tử agon có kí hiệu là – Hãy xác định số proton, số proton trong hạt nhân và số electron ở vỏ electron của nguyên tử. – Hãy xác định sự phân bố electron trên các lớp. ° Lời giải bài 6 trang 22 SGK Hóa 10: – Ta có, Z= 18 suy ra trong hạt nhân Ar có 18p và 22n (40 – 18), lớp vỏ electron của nguyên tử có 18e được phân bố như sau: 1s22s22p63s23p6. Hy vọng với bài viết về Cấu tạo vỏ nguyên tử, phân lớp Electron, lớp Electron bão hòa và bài tập ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt. Đăng bởi: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/hoa-10-bai-4-cau-tao-vo-nguyen-tu-phan-lop-electron-va-bai-tap/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




