Hóa học 11 Bài 1: Sự điện li được Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 1
Sự điện li
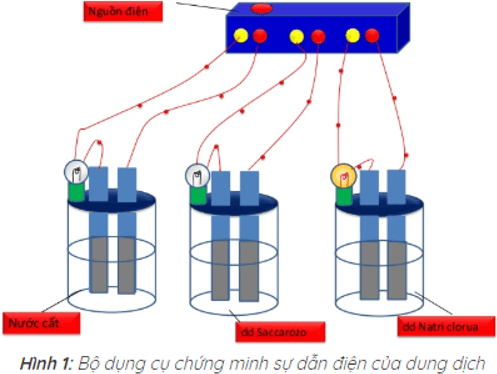
Bạn đang xem bài: Hóa học 11 Bài 1: Sự điện li – Giải bài tập SGK Hóa học 11 Bài 1
Kết quả thí nghiệm cho thấy chỉ có bóng đèn ở cốc đựng dung dịch NaCl sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozo không dẫn điện.
Nguyên nhân tính dẫn điện của các dung dịch axit, bazo và muối trong nước
– Các axit, bazo, muối khi tan trong nước phân li ra các ion làm cho dung dịch của chúng có tính dẫn điện.
– Quá trình phân li các chất trong nước ra ion gọi là sự điện li.
– Những chất tan trong nước phân li ra ion gọi là chất điện li.
– Sự điện li được biểu diễn bằng phương trình điện li.
NaCl → Na+ + Cl–
HCl → H+ + Cl–
NaOH → Na+ + OH–
Kết luận
a. Sự điện li: là quá trình phân li các chất trong nước ra ion.
b. Chất điện li: là những chất tan trong nước phân li ra được ion. Dung dịch trong nước của các chất điện li sẽ dẫn điện được.
c. Phương trình điện li
AXIT → Cation H+ + Anion gốc axit
BAZƠ → Cation KL + Anion OH–
MUỐI → Cation KL (hoặc NH4+) + Anion gốc axit
d. Các hệ quả:
– Trong một dung dịch, tổng ion dương = tổng ion âm.
– Tổng số gam các ion sẽ bằng tổng số gam các chất tan có trong dung dịch đó.
Giải bài tập SGK Hóa học 11 Bài 1
Bài 1 (trang 7 SGK Hóa 11)
Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện được là do nguyên nhân gì?
Lời giải:
Trong dung dịch: các axit, các bazơ, các muối phân li ra các ion dương và ion âm chuyển động tự do nên dung dịch của chúng có khả năng dẫn điện.
Thí dụ :
HCl → H+ + Cl–
NaOH → Na+ + OH–
NaCl → Na+ + Cl–
Còn các dung dịch như ancol etylic, đường saccarazơ, glixerol không dẫn điện vì trong dung dịch chúng không phân li ra các ion dương và ion âm.
Bài 2 (trang 7 SGK Hóa 11)
Sự điện li, chất điện li là gì? Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy thí dụ và viết phương trình điện li của chúng?
Lời giải:
– Sự điện li là sự phân li thành các cation (ion dương) và anion (ion âm) của phân tử chất điện li khi tan trong nước.
– Chất điện li là những chất tan trong nước và tạo thành dung dịch dẫn được điện.
– Các chất là chất điện li như axit, các bazơ, các muối tan được trong nước.
– Chất điện li mạnh là những chất khi tan trong nước các phân tử hoà tan đều phân li ra ion.
– Thí dụ:
H2SO4 → 2H+ + SO42-
KOH → K+ + OH–
Na2SO4 → 2Na+ + SO42-
– Chất điện li yếu là những chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
– Thí dụ: H2S ⇌ H+ + HS–
Bài 3 (trang 7 SGK Hóa 11)
Viết phương trình điện li của những chất sau:
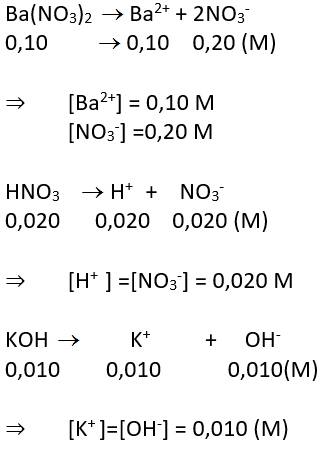
a. Các chất điện li mạnh: Ba(NO3)2 0.10 M; HNO3 0,020 M; KOH 0,010 M. Tính nồng độ mol của từng ion trong dung dịch.
b. Các chất điện li yếu HClO; HNO2.
Lời giải:
a. Các chất điện li mạnh
b. Các chất điện li yếu HClO; HNO2
HClO ⇌ H+ + ClO–
HNO2 ⇌ H+ + NO2–
Bài 4 (trang 7 SGK Hóa 11)
Chọn câu trả lới đúng trong các câu sau đây:
Dung dịch chất điện li dẫn được điện là do:
A. Sự dịch chuyển của các electron.
B. Sự dịch chuyển của các cation.
C. Sự dịch chuyển của các phân tử hoà tan.
D. Sự dịch chuyển của cả cation và anion.
Lời giải:
Đáp án D.
Do khi hoà tan (trong nước) các phân tử chất điện li phân li ra thành các cation và anion.
Bài 5 (trang 7 SGK Hóa 11)
Chất nào sau đây không dẫn điện được?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hoà tan trong nước.
Lời giải:
Đáp án A.
Do KCl rắn, khan tồn tại dưới dạng mạng tinh thể ion, rất bền vững. Không phân li ra được ion dương và ion âm (di chuyển tự do) nên không có khả năng dẫn điện.
Trắc nghiệm Hóa học 11 Bài 1 có đáp án
Bài 1: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion SO42- trong X là
A. 0,2M.
B. 0,8M.
C. 0,6M.
D. 0,4M.
Lời giải
Đáp án: B
Phản ứng điện li:
MgSO4 → Mg2+ + SO42-
Al2(SO4)3 → 2Al3+ + 3SO42-
nSO42- = 0,4 mol
⇒ CM(SO42-) = 0,4 / 0,5 = 0,8 (M)
Bài 2: Trộn 400 ml dung dịch Fe2(SO4)3 0,2M với 100 ml dung dịch FeCl3 0,3m thu được dung dịch Y. Nồng độ ion Fe3+ trong Y là
A. 0.38M.
B. 0,22M.
C. 0,19M.
D. 0,11M.
Lời giải
Đáp án: A
Bài 3: Một dung dịch chứa các ion : Cu2+ (0,02 mol), K+ (0,10 mol), NO3– (0,05 mol) và SO42- (x mol). Giá trị của x là
A. 0,050.
B. 0.070.
C. 0,030.
D. 0,045.
Lời giải
Đáp án: D
Theo bảo toàn điện tích: 2nCu2+ + nK+ = nNO3– + nSO42-
⇒ 2.0,02 + 0,1 = 0,05 + 2x ⇒ x = 0,045 (mol)
Bài 4: Một dung dịch chứa Mg2+ (0,02 mol), K+ (0,03 mol) , Cl– (0,04 mol) và ion Z (y mol). Ion Z và giá trị của y là
A. NO3–(0,03).
B. CO32-(0,015).
C. SO42- (0,01).
D. NH4+ (0,01)
Lời giải
Đáp án: A
Gọi điện tích của ion Z là x, số mol là y
Theo bảo toàn điện tích: 2nMg2+ + nK+ + (-1)nCl– + xy = 0
⇒ xy = -0,03
Vậy Z là anion
Đáp án phù hợp là A: x = -1, y = 0,03 mol. Anion là NO3–
Nếu x = -2, y = 0,015 mol, anion là CO32- loại, vì ion này tạo kết tủa với Mg2+
Bài 5: Dung dịch X gồm : 0,09 mol Cl– , 0,04 mol Na+ , a mol Fe3+ và b mol SO . Khi cô cạn X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là
A. 0.05 và 0,05.
B. 0,03 và 0,02.
C. 0,07 và 0,08.
D. 0,018 và 0,027.
Lời giải
Đáp án: B
Theo bảo toàn điện tích: 3a + 0,04 = 0,09 + 2b (1)
Theo bảo toàn khối lượng: 56a + 0,04. 23 + 0,09. 35,5 + 96b = 7,715 (2)
Giải hệ 1 và 2 ⇒ a = 0,03 và b = 0,02
Bài 6: Có 4 dung dịch: Natri clorua, rượu etylic, axit axetic, kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
A. NaCl < C2H5OH < CH3COOH < K2SO4.
B. C2H5OH < CH3COOH < NaCl < K2SO4.
C. C2H5OH < CH3COOH < K2SO4< NaCl.
D. CH3COOH < NaCl < C2H5OH < K2SO4.
Lời giải
Đáp án: B
Bài 7: Trong dung dịch axit nitric (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NO3–.
B. H+, NO3–, H2O.
C. H+, NO3–, HNO3.
D. H+, NO3–, HNO3, H2O.
Lời giải
Đáp án: B
Bài 8: Trong dung dịch axit axetic (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, CH3COO–.
B. H+, CH3COO–, H2O.
C. CH3COOH, H+, CH3COO–, H2O.
D. CH3COOH, CH3COO–, H+.
Lời giải
Đáp án: C
Bài 9: Cho các chất: phèn K – Al; C2H5OH; glucozơ; saccarozơ; tinh bột; dầu ăn; CH3COOH; HCOOCH3; CH3CHO; C3H6; Ca(OH)2; CH3COONH4; NaHCO3; KAlO2; C2H4(OH)2; Phèn amoni – sắt. Số chất điện li là:
A. 6
B. 7
C. 9
D. 8
Lời giải
Đáp án: B
Các chất điện li: phèn K – Al (là muối của K và Al); CH3COOH; Ca(OH)2; CH3COONH4; NaHCO3; KAlO2, Phèn amoni – sắt ( muối của sắt và amoni)
Bài 10: Chất nào sau đây không dẫn điện được?
A. KCl rắn, khan.
B. CaCl2nóng chảy.
C. NaOH nóng chảy.
D. HBr hòa tan trong nước
Lời giải
Đáp án: A
Bài 11: Phương trình điện li nào sau đây không đúng?
A. HCl → H++ Cl–
B. CH3COOH ⇌ CH3COO–+ H+
C. H3PO4→ 3H++ PO43-
D. Na3PO4→ 3Na++ PO43-
Lời giải
Đáp án: C
Bài 12: Phương trình điện li nào sau đây viết đúng?
A. H2SO4⇌ H++ HSO4–
B. H2CO3⇌ 2H++ HCO3–
C. H2SO3→ 2H++ SO32-
D. Na2S ⇌ 2Na++ S2-
Lời giải
Đáp án: B
Bài 13: Các chất dẫn điện là
A. KCL nóng chảy, dung dịch NaOH, dung dịch HNO3.
B. dung dịch glucozơ , dung dịch ancol etylic , glixerol.
C. KCL rắn khan, NaOH rắn khan, kim cương.
D. Khí HCL, khí NO, khí O3.
Lời giải
Đáp án: A
Bài 14: Dãy các chất đều là chất điện li mạnh là
A. KOH, NaCL, H2CO3.
B. Na2S, Mg(OH)2, HCl.
C. HClO, NaNO3, Ca(OH)3.
D. HCl, Fe(NO3)3, Ba(OH)2.
Lời giải
Đáp án: D
Bài 15: Trong dung dịch CH3COOH 0,043M, cứ 100 phân tử hòa tan có 2 phân tử phân li thành ion. Nồng độ của ion H+ là
A. 0,001M.
B. 0,086M.
C. 0,00086M.
D. 0,043M.
Lời giải
Đáp án: C
Độ điện li của CH3COOH là 0,02.
CM H+ = 0,043. 0,02 = 0,00086 (mol)
******************
Trên đây là nội dung bài học Hóa học 11 Bài 1: Sự điện li do Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Sự điện li. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá
Chuyên mục: Hoá học 11
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/hoa-hoc-11-bai-1-su-dien-li/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




