Al + HNO3 → Al(NO3)3 + N2 + H2O được Tmdl.edu.vn biên soạn là phản ứng oxi hóa khử khi cho Al tác dụng với dung dịch HNO3 loãng sau phản ứng thu được muối nhôm và khí nito. Hy vọng với phương trình phản ứng Al phản ứng HNO3 loãng, bạn đọc sẽ biết cách viết và cân bằng chính xác phản ứng.
Phương trình phản ứng Al tác dụng HNO3
10Al + 36HNO3 loãng → 10Al(NO3)3 + 3N2 + 18H2O
Bạn đang xem bài: Al + HNO3 → Al(NO3)3 + N2 + H2O
Cách cân bằng phản ứng Al tác dụng HNO3
Xác định vai trò của từng chất tham gia phản ứng và nêu sự oxi hóa, sự khử:
Al0 + H+5NO3 loãng →Al+3(NO3)3+ N02+ H2O
Số oxi hóa của Al tăng từ 0 lên +3 => Al là chất khử
Số oxi hóa của N giảm từ +5 xuống 0 => HNO3 là chất oxi hóa
Sự oxi hóa: Al → Al+3 + 3e
Sự khử: 2N+5 + 10e → N2
b) Cân bằng phản ứng trên theo phương pháp thăng bằng electron.
0Al + H+5NO3 loang →+3Al(NO3)3 + 0N2 + H2O
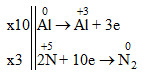
Điều kiện phản ứng xảy ra Al tác dụng HNO3
Dung dịch HNO3 loãng
Ứng dụng của HNO3
HNO3 phản ứng với hầu hết với các hợp chất hữu cơ nên nó được sử dụng nhiều trong ngành luyện kim, tinh lọc và xi mạ. Khi cho axit nitric tác dụng với axit clorua, ta được dung dịch cường toan có khả năng hòa tan và và bạch kim. Axit nitric còn được sử dụng trong sản xuất các chất hữu cơ, sơn, bột màu, thuốc nhuộm vải.
Bài tập vận dụng liên quan
Câu 1. Phát biểu nào sau đây là sai?
A. Dung dịch AlCl3 và Al2(SO3)3 làm quỳ tím hóa hồng
B. Al(OH)3, Al2O3, Al đều là các chất lưỡng, tính
C. Nhôm là kim loai nhẹ và có khả năng dẫn điện Iot
D. Từ Al2O3 có thế điều chế được Al.
Đáp án B
Sai: Al(OH)3, Al2O3, Al đều là các chất lưỡng, tính
Al không phải chất lưỡng tính
Câu 2. Hiện tượng nào xảy ra khi cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3?
A. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện
B. Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần
C. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện, rồi tan dần.
D. Xuất hiện kết tủa keo trắng ngay lập tức và không tan,
Đáp án B
Phương trình phản ứng
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần
Câu 3. Cho 3,82 gam hợp kim Ba, Al vào nước dư chỉ thu được dung dịch chưa duy nhất một muối. Khối lượng Ba là:
A. 3.425 gam.
B. 1,644 gam.
C. 1,370 gam,
D. 2,740 gam
Đáp án D: Công thức muối Ba(AlO2)2 ⇒ nAl = 2nBa ⇒ mBa = 2,740 gam
Câu 4. Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp theo quan sát được là:
A. khí hiđro thoát ra mạnh.
B. khí hiđro thoát ra sau đó dừng lại ngay.
C. lá nhôm bốc cháy.
D. lá nhôm tan ngay trong thủy ngân và không có phản ứng.
Đáp án A
2Al + 3Hg(NO3)2 → 2Al(NO3)3 + 3Hg
Al sẽ tạo với Hg hỗn hống. Hỗn hống Al tác dụng với nước
2Al + 6H2O → 2Al(OH)3 + 3H2
Câu 5. Cho sơ đồ phản ứng sau: Al → X → Al2O3 → Y→ Z → Al(OH)3
X, Y, Z lần lượt có thể là:
A. Al(NO3)3, NaAlO2, AlCl3
B. Al(NO3)3, Al(OH)3, AlCl3
C. AlCl3, Al2(SO4)3, NaAlO2
D. AlCl3, NaAlO2, Al2(SO4)3
Đáp án A
Al → X (Al(NO3)3) → Al2O3 → Y(NaAlO2) → Z(AlCl3) → Al(OH)3
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
2Al(NO3)3 → Al2O3 + 6NO2 + 3/2O2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
NaAlO2 + 4HCl → NaCl + AlCl3 + 2H2O
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
Câu 6. Nhỏ từ từ cho đến dư dung dịch KOH vào dung dịch AlCl3 hiện tượng xảy ra là
A. Có kết tủa keo trắng, sau đó kết tủa tan.
B. Chỉ có kết tủa keo trắng.
C. Có kết tủa keo trắng và khí bay lên.
D. Không có kết tủa, có khí bay lên.
Đáp án A
Nhỏ từ từ cho đến dư dung dịch KOH vào dung dịch AlCl3, ban đầu có kết tủa keo trắng xuất hiện.
3KOH + AlCl3 → Al(OH)3 ↓ + 3NaCl
Sau đó kết tủa keo trắng tan trong NaOH dư tạo dung dịch trong suốt (vì Al(OH)3 có tính lưỡng tính tan được trong dung dịch axit dư, và kiêm dư)
KOH + Al(OH)3 → KAlO2 + 2H2O
Câu 7. Cặp chất nào sau đây có thể tồn tại được trong cùng một dung dịch
A. AlCl3 và Na2CO3
B. KNO3 và NaOH
C. AgNO3 và KCl
D. BaCl2 và H2SO4
Đáp án B
A. Al2(SO4)3 + 3Na2CO3 → Al2(CO3)3 + 3Na2SO4
C. KCl + AgNO3 → AgCl + KNO3
D. H2SO4 + BaCl2 → BaSO4 + 2HCl
Câu 8. Chất nào sau đây lưỡng tính?
A. Fe(OH)3.
B. Mg(OH)2.
C. NaCl.
D. Al(OH)3.
Đáp án D
Câu 9. Cho 300 ml dung dịch NaOH 2M vào 200ml dung dịch Al2(SO4)3 0,4M, lắc đều cho đến khi phản ứng kết thúc ta thu được kết tủa Z. Tính khối lượng kết tủa thu được.
A. 1,56 gam.
B. 3,12 gam.
C. 6,24 gam.
D. 2,34 gam.
Đáp án B
Ta có theo đầu bài
nNaOH = 0,15.2 = 0,6 mol;
nAl2(SO4)3 = 0,1.0,4 = 0,08 mol.
Phương trình hóa học:
6NaOH + Al2(SO4)3 → 3Na2SO4 + 2Al(OH)3 ↓
Theo đề bài 0,6 0,08
Phản ứng: 0,48 ← 0,08 → 0,16 mol
Sau phản ứng: 0,12 0,16 mol
NaOH + Al(OH)3 → NaAlO2 + 2H2O
0,12 → 0,12 mol
⟹ n↓= 0,16 – 0,12 = 0,04 mol
⟹ m↓ = 0,04.78 = 3,12 gam.
Câu 10. Cho 1 lít dung dịch NaOH tác dụng với 600 ml dung dịch Al2(SO4)3 0,2M thu được 3,12 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn.Nồng độ mol/lít của dung dịch NaOH.
A. 0,12M
B. 0,12M hoặc 0,92M
C. 0,92M
D. 0,15M hoặc 0,92M
Đáp án B
Theo bài ra, ta có: nAl2(SO4)3 = 0,6.0,2 = 0,12 (mol) ⇒ nAl3+ = 2.0,12 = 0,24 (mol).
Cũng theo bài ra, nAl(OH)3 = 3,12 /78 = 0,04 (mol).
Ta thấy n↓ < nAl3+ và bài không yêu cầu tính lượng NaOH là min hay max nên có 2 trường hợp xảy ra:
TH1: Chỉ tạo kết tủa và Al3+ còn dư, khi đó chỉ xảy ra phản ứng tạo kết tủa.
Al3+ + 3OH- → Al(OH)3
0,12 0,04
=> [NaOH] = n/V= 0,12/1 = 0,12M.
TH2: Kết tủa sinh ra và bị hòa tan một phần.
n↓còn lại = 4nAl3+ – nOH– → nOH- = 4nAl3+ – n↓ = 4.0,24 – 0,04 = 0,92 mol.
=> [NaOH] = n/V= 0,92/1 = 0,92 M.
Câu 11. Trong các cặp chất sau đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và K2CO3
B. HNO3 và KHCO3
C. KAlO2 và NaOH
D. NaCl và AgNO3
Đáp án A
Câu 12. Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3 ?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch Ca(OH)2
Đáp án C
Câu 13. Cho 1 gam kim loại R vào 200 ml dung dịch AgNO3 0,25M đến khi phản ứng hoàn toàn thu được dung dịch không chứa ion Ag+ và có khối lượng giảm so với khối lượng của dung dịch AgNO3 ban đầu là 4,4 gam. Kim loại R là?
A. Cu.
B. Ca.
C. Zn.
D. Fe.
Đáp án D
*Trường hợp 1: R (hóa trị n) phản ứng trực tiếp với AgNO3
Phương trình phản ứng:
R + nAgNO3→ R(NO3)n + nAg
0,05/n → 0,05 → 0,05 mol
mdd giảm= mAg– mR pứ= 0,05.108 – 0,05R/n= 4,4
→ R/n= 20 → Loại
*Trường hợp 2: R là Ca
Ca + H2O → Ca(OH)2 + H2
0,025 → 0,025 → 0,025 mol
Ca(OH)2 + 2AgNO3→ Ca(NO3)2+ 2AgOH ↓
0,025 → 0,05 → 0,05
2AgOH → Ag2O + H2O
0,05 → 0,025 mol
ndd giảm = mAg2O + mH2 – mCa = 0,025.232 + 0,025.2 – 1= 4,85 gam: Loại
*Vậy R là Fe.
2.nFe < nAgNO3 < 3.nFe → Fe tan hết, Ag+ chuyển hết thành Ag
mdd giảm= mAg– mFe = 0,05.108 – 1= 4,4 gam
Câu 14. Nhúng một đinh sắt vào 200ml dung dịch CuSO4 1M. Sau một thời gian lấy đinh sắt ra, sấy khô và đem cân thì thấy khối lượng đinh sắt tăng lên 0,4g. Xem như thể tích dung dịch thay đổi không đáng kể. Vậy nồng độ của CuSO4 còn lại sau phản ứng là:
A. 0,75M
B. 0,5M
C. 0,65M
D. 0,8M
Đáp án A
Số mol CuSO4 ban đầu là 0,2 mol
Gọi x là số mol Fe phản ứng:
Fe + CuSO4 → FeSO4 + Cu
x → x → x
56x (g) 64x (g)
Khối lượng định sắt tăng lên là: 64x – 56x = 8x
Ta có: 8x = 0,4 → x = 0,05 mol
Số mol CuSO4 dư = 0,2 – 0,05 = 0,15 mol
CMCuSO4= 0,15/0,2 = 0,75M
Trên đây tmdl.edu.vn đã gửi tới bạn Al + HNO3 → Al(NO3)3 + N2 + H2O. Nội dung tài liệu gồm 3 phần, phần đầu giúp các bạn hoàn thành phương trình hóa học đã cho, các mục sau là bổ trợ, mở rộng cho phần cân bằng phản ứng hóa học.
Bản quyền bài viết thuộc Tmdl.edu.vn. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá (tmdl.edu.vn)
Trang chủ: tmdl.edu.vn
Danh mục bài: Công thức Hóa Học