Các em đã được học về tính chất hóa học của Cacbon, Oxit của các bon như (cacbonmonooxit CO, cacbon dioxit CO2) và các hợp chất của cacbon như axit cacbonic muối cacbonat.
Nếu các em có thể xem lại tính chất hóa học của cacbon và hợp chất của cacbon nếu chưa ghi nhớ kiến thức này. Ở bài viết dưới đây, chúng ta sẽ tập trung vào một số dạng bài tập vê cacbon, các oxit của cácbon và hợp chất của cácbon.
Bạn đang xem bài: Bài tập Các-bon các Oxit của Các-bon và hợp chất của Các-bon – Hóa lớp 11
I. Bài tập về tính chất hóa học của cacbon
* Ví dụ 1: Cho các chất: O2 (1),CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 (đặc) (8), HNO3 (9), H2O (10), KMnO4 (11). Cacbon phản ứng trực tiếp với những chất nào? Viết PTHH.
* Lời giải:
– Các chất mà cacbon có thể phản ứng là:
O2 ; CO2 ; H2 ; Fe2O3 ; SiO2 ; HCl ; CaO ; H2SO4 (đặc) ; HNO3 (đặc) ; H2O;
– Các phương trình hóa học như sau:
(1): C + O2 → CO2
(2): C + CO2 → 2CO
(3): C + 2H2 ![xrightarrow[]{t^0} 1605062407in3jfob094 1605069365 1605079979](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605062407in3jfob094_1605069365_1605079979.gif) CH4
CH4
(4): Fe2O3 + 3C ![xrightarrow[]{t^0} 1605062407in3jfob094 1605069365 1605079979](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605062407in3jfob094_1605069365_1605079979.gif) 2Fe + 3CO
2Fe + 3CO
(5): 2C + SiO2 ![xrightarrow[]{t^0} 1605062407in3jfob094 1605069365 1605079979](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605062407in3jfob094_1605069365_1605079979.gif) Si + 2 CO
Si + 2 CO
(7): CaO + 3C → CaC2 + CO (trong lò điện)
(8): C + 2H2SO4 (đặc) ![xrightarrow[]{t^0} 1605062407in3jfob094 1605069365 1605079979](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605062407in3jfob094_1605069365_1605079979.gif) CO2 + 2SO2 + 2H2O
CO2 + 2SO2 + 2H2O
(9): C + 4HNO3 (đặc) ![xrightarrow[]{t^0} 1605062407in3jfob094 1605069365 1605079979](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605062407in3jfob094_1605069365_1605079979.gif) CO2 + 4NO2 + 2H2O
CO2 + 4NO2 + 2H2O
(10): C + 2H2O → CO2 + 2H2
* Ví dụ 2: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 (nóng) sau khi phản ứng xảy ra hoàn toàn thu được chất rắn nào?
A. Al, Fe, Cu, Mg.
B. Al2O3, Cu, MgO, Fe
C. Al2O3, Cu, Mg, Fe
D. MgO, Al2O3, CuO, Fe2O3
* Lời giải:
¤ Chọn đáp án: B
– Khí CO có thể khử được các oxit kim loại đứng sau Al trong dãy điện hóa, tạo thành kim loại và khí cacbonic.
– Như vậy trong các oxit trên, CO chỉ khử được CuO và Fe2O3 ; CO không khử được Al2O3 và MgO.
– Các phương trình phản ứng như sau:
Fe2O3 + 3CO ![xrightarrow[]{t^0} 1605062407in3jfob094 1605069365 1605079979](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605062407in3jfob094_1605069365_1605079979.gif) 2Fe + 3CO2
2Fe + 3CO2
CuO + CO ![xrightarrow[]{t^0} 1605062407in3jfob094 1605069365 1605079979](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605062407in3jfob094_1605069365_1605079979.gif) Cu + CO2
Cu + CO2
* Ví dụ 3: Khí CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, CO2 không dùng để dập tắt đám cháy nào dưới đây?
A. Đám cháy do xăng, dầu.
B. Đám cháy nhà cửa, quần áo.
C. Đám cháy do magie hoặc nhôm.
D. Đám cháy do khí ga.
* Lời giải:
¤ Đáp án: C. Đám cháy do magie hoặc nhôm.
– Lý do: Các kim loại có tính khử mạnh như: Mg, Al có thể cháy được trong khí CO2
CO2 + Mg ![xrightarrow[]{t^0} 1605062407in3jfob094 1605069365 1605079979](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605062407in3jfob094_1605069365_1605079979.gif) MgO + C
MgO + C
* Ví dụ 4: Có 3 muối dạng bột NaHCO3, Na2CO3 và CaCO3. Chọn hoá chất thích hợp để nhận biết mỗi chất
A. Qùy tím
B. Phenolphtalein
C. Nước và HCl
D. Qùy tím và HCl
* Lời giải:
¤ Đáp án: C. Nước và HCl
– Hoá chất thích hợp để nhận biết mỗi chất là Nước và HCl.
|
|
NaHCO3 |
Na2CO3 |
CaCO3 |
|
Nước |
Tan |
Tan |
Không tan |
|
Nhỏ từ từ HCl |
Có khí thoát ra ngay |
Khí thoát ra sau một thời gian |
|

II. Bài tập CO2 tác dụng với dung dịch kiềm
* Phương pháp giải:
– Các phương trình hóa học có thể có:
CO2 + OH– → HCO3–
CO2 + 2OH– → CO32- + H2O
Đặt 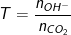 , ta có:
, ta có:
|
Giá trị của T |
Chất thu được sau phản ứng |
|
T < 1 |
Muối hidro cacbonat và CO2 dư |
|
T = 1 |
Muối hidro cacbonat (HCO3–) |
|
T = 2 |
Muối cacbonat (CO32-) |
|
T > 2 |
Muối cacbonat và dung dịch kiềm dư |
|
1 < T < 2 |
Muối hidro cacbonat và muối cacbonat |
– Nếu tạo thành hỗn hợp hai muối thường ta giải bằng cách lập hệ phương trình hoặc sử dụng định luật bảo toàn nguyên tố.
* Ví dụ 1: Cho 7,84 lít khí CO2 (đktc) tác dụng với 250 ml dung dịch KOH 2M sau phản ứng, cô cạn dung dịch thu được tổng khối lượng sản phẩm rắn là bao nhiêu?
* Lời giải:
– Bài cho: VCO2 = 7,84(l) ở (đktc) ⇒ nCO2 = V/22,4 = 7,84/22,4 = 0,35(mol).
– VKOH = 250(ml) = 0,25(l) ⇒ nKOH = CM.V = 2.0,25 = 0,5(mol)
– Lập tỉ lệ: T = nOH– / nCO2 = 0,5/0,35 = 10/7 suy ra: 1 < T < 2.
→ Tạo 2 muối kali cacbonat K2CO3 và kali hidro cacbonat KHCO3
– Tuy nhiên khi cô cạn dung dịch thì muối KHCO3 bị nhiệt phân thành K2CO3
KHCO3 ![xrightarrow[]{t^o}](https://tmdl.edu.vn/wp-content/uploads/2023/03/1605069369s29jpxeh0z_1605079981.gif) K2CO3 + H2O + CO2
K2CO3 + H2O + CO2
– Áp dụng định luật bảo toàn nguyên tố K, ta được:
nK2CO3 = 0,25(mol) ⇒ m = n.M = 0,25.138 = 34,5(g).
* Ví dụ 2: Cho 5,6 lít CO2 (đktc) hấp thụ hoàn toàn trong dung dịch chứa 0,18 mol Ca(OH)2. Tính khối lượng kết tủa thu được?
* Lời giải:
– Theo bài ra, VCO2 = 5,6(l) ở (đktc) ⇒ nCO2 = V/22,4 = 5,6/22,4 = 0,25(mol)
– Lại có: nCa(OH)2 = 0,18 (mol) ⇒ nOH– = 2nCa(OH)2 = 2.0,18 = 0,36 (mol).
– Lập tỉ lệ: T = nOH– /nCO2 = 0,36/0,25 = 1,44, ta thấy 1<T<2 nên sau phản ứng thu được 2 muối
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
x(mol) x x(mol)
2CO2 + Ca(OH)2 → Ca(HCO3)2 + H2O (2)
y(mol) y/2 y/2(mol)
– Theo phương trình phản ứng, ta có:
nCO2 = x + y = 0,25 (*)
nCa(OH)2 = x + y/2 = 0,18 (**)
– Giải hệ (*) và (**) ta được: x = 0,11; y = 0,14
– Theo PTPƯ (1) thì: nCaCO3 = nCO2 = x = 0,11 mol
⇒ Khối lượng kết tủa CaCO3 thu được là: m = n.M = 0,11.100 – 11(g).
> Lưu ý: Với bài toán này có thể sự dụng công thức tính nhanh:
nCO32- = nOH– – nCO2 := 0,36 – 0,25 = 0,11 (mol)
⇒ Khối lượng kết tủa CaCO3 thu được là: m = n.M = 0,11.100 – 11(g).
* Ví dụ 3: Sục 4,48l khí CO2 (đktc) vào 500ml dd NaOH 0,1M và Ba(OH)2 0,2M. Tính m kết tủa thu được?
* Lời giải:
– Theo bài ra, ta có:
nCO2 = 4,48/22,4 = 0,2(mol); nNaOH = 0,5.0,1 = 0,05(mol);
nBa(OH)2 = 0,5.0,2 = 0,1(mol) ⇒ nBa2+ = 0,1(mol).
⇒ nOH– = nNaOH + 2nBa(OH)2 = 0,05 + 2.0,1 = 0,25(mol);
– Ta có T = nOH–/nCO2 = 0,25/0,2 = 5/4; ta thấy 1<T<2 nên tạo 2 muối.
CO2 + 2OH– → CO32- + H2O
x(mol) 2x(mol) x mol
CO2 + OH– → HCO3–
y(mol) y y
– Từ PTPƯ ta có hệ:
x + y = 0,2 (*)
2x + y = 0,25 (**)
– Giải hệ từ (*) và (**) ta được: x = 0,05 và y = 0,15.
⇒ nCO32- = 0,05mol
Ba2+ + CO32- → BaCO3↓
0,05 0,05
⇒ Khối lượng kết của thu được là: mBaCO3↓ = 0,05.197 = 9,85(g)
* Ví dụ 4: Cho 1,344 lít khí CO2 (đktc) hấp thụ hết vào 2 lít dung dịch X chứa NaOH 0,04M và Ca(OH)2 0,02M thu được m gam kết tủa. Xác định giá trị của m.
* Lời giải:
– Theo bài ra, ta có: nCO2 = 1,344/22,4 = 0,06 (mol);
nNaOH = 0,04.2 = 0,08 (mol); nCa(OH)2 = 0,02.2 = 0,04 (mol);
⇒ nOH– = nNaOH + 2nCa(OH)2 = 0,08 + 0,04.2 = 0,16 (mol).
– Xét tỉ lệ: T= nOH–/nCO2 = 0,16/0,06 = 8/3 > 2 nên chỉ tạo ra muối CO32-
– Phương trình phản ứng:
CO2 + OH– → CO32-
0,06 0,06 mol
CO32- + Ca2+ → CaCO3↓
0,04 0,04 0,04 mol
⇒ Khối lượng kết tủa thu được: mCaCO3↓ = n.M = 0,04.100 = 4 (g).
* Ví dụ 5: Sục 3,36 lít khí CO2 (đktc) vào 300ml dd Ca(OH)2 0,2M và NaOH 0,3 M thu được m (g) kết tủa và dd Y. Cô cạn dd Y thu được m'( g) chất rắn khan. Tìm m và m’?
* Lời giải:
– Theo bài ra, ta có: nCO2 = 3,36/22,4 = 0,15 mol, nNaOH = 0,3.0,3 = 0,09(mol);
nCa(OH)2 = 0,3.0,2 = 0,06(mol) ⇒ nCa2+ = 0,06 mol
⇒ nOH– = nNaOH + 2nCa(OH)2 = 0,09 + 2.0,06 = 0,21(mol);
– Xét tỉ lệ: T= nOH–/nCO2 = 0,21/0,15 = 7/5, thấy 1<T<2 nên tạo hai muối.
CO2 + 2OH– → CO32- + H2O
x(mol) 2x x(mol)
CO2 + OH– → HCO3–
y(mol) y y(mol)
– Theo PTPƯ ta có:
x + y = nCO2 = 0,15(mol) (*)
2x + y = nOH– = 0,21(mol) (**)
– Giải hệ từ (*) và (**) ta được: x = 0,06 và y = 0,09
Ca2+ + CO32- → CaCO3↓
0,06 0,06 0,06(mol)
⇒ Khối lượng CaCO3 kết tủa thu được là: mCaCO3↓ = 0,06.100 = 6(g).
⇒ Chất rắn thu được là NaHCO3 ⇒ m’crắn = 0,09.84 = 7,56(g).
* Ví dụ 6: Cho V lít CO2 (đktc) tác dụng 500ml dung dịch Ca(OH)2 0,5M tạo thành 10 gam kết tủa . Tính giá trị của V?
* Lời giải:
– Theo bài ra, ta có: nCa(OH)2 = 0,5.0,5 = 0,25; nCaCO3 = 10/100 = 0,1 (mol).
⇒ nOH– = 2.nCa(OH)2 = 2.0,25 =0,5 (mol).
¤ TH1: nCO2 = n↓ = 0,1 mol
⇒ Thể tích CO2 tham gia phản ứng là: V = 0,1.22,4 = 2,24 lít
¤TH2: nCaCO3 < nCa(OH)2 ⇒ tạo thành 2 muối của CO32- và HCO3–
– Từ công thức tính nhanh: nCO32- = nOH– – nCO2
⇒ nCO2 = nOH– – nCO32- = 0,5 – 0,1 = 0,4 ⇒ V = 8,96 lit
⇒ Vậy giá trị của V là 2,24 lít hoặc 8,96 lít
* Ví dụ 7: Cho 11,2 lít CO2 (đktc) hấp thụ hết trong dung dịch chứa a mol Ca(OH)2 và 0,2 mol NaOH. Xác định giá trị của a để sau phản ứng thu được 10 gam kết tủa.
* Lời giải:
– Theo bài ra, ta có: nCO2 = 0,5 (mol); nCaCO3 = 0,1 (mol).
¤ TH1: thu được 1 muối CO32-
⇒ nCa2+ = nCaCO3 = 0,1 mol ⇒ a = 0,1
– Kiểm tra lại:
nOH- = 2.nCa(OH)2 + nNaOH = 2.0,1 + 0,2 = 0,4 mol
Mà thu được muối CO32- thì nOH– ≥ 2.nCO2 ⇔ 0,4 ≥ 2.0,5 (vô lí)
⇒ Loại trường hợp này.
¤ TH2: thu được 2 muối HCO3– và CO32-
– Sử dụng công thức tính nhanh:
nCO32- = nOH– – nCO2 = 2a + 0,2 – 0,5 = 0,1 ⇒ a = 0,2 (mol).
III. Khử Oxit kim loại bằng C và CO
* Phương pháp giải:
– Phương trình phản ứng khử tổng quát:
M2On + nCO ![xrightarrow[]{t^0}](https://tmdl.edu.vn/wp-content/uploads/2023/03/16050799841xnwhu3l1y.gif) 2M + nCO2↑
2M + nCO2↑
– Sử dụng định luật bảo toàn nguyên tố C để giải toán kết hợp với định luật bảo toàn khối lượng.
moxit KL + mCO = mKL + mCO2
→ nO(Oxit) = nCO = nCO2 và moxitKL = mKL + mO
> Chú ý: Đốt cháy Cacbon bởi oxi: Có 2 trường hợp
+) Nếu thừa oxi: C + O2 → Hỗn hợp khí sau phản ứng gồm CO2 và O2 (dư).
+) Nếu thiếu oxi: C + O2 → Hỗn hợp khí sau phản ứng gồm CO2 và CO dư.
* Ví dụ 1: Khử 16g hỗn hợp các oxit kim loại: FeO, Fe2O3, Fe3O4, CuO, PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 g. Tính thể tích khi CO đã tham gia phản ứng (đktc)
* Lời giải:
– Áp dụng ĐLBT khối lượng: nCO2 = nCO = x (mol).
mOxit + mCO = mC.rắn + mCO2
16 + 28x = 11,2 + 44x ⇒ x=0,3
⇒ VCO = 0,3.22,4 = 6,72 (lít).
* Ví dụ 2: Dẫn một luồng khí CO dư qua ống sứ đựng Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Tính tổng khối lượng 2 oxit trong hỗn hợp đầu.
* Lời giải:
– Phương trình phản ứng:
4CO + Fe3O4 → 3Fe + 4CO2↑
CO + CuO → Cu + CO2↑
CO2 + Ca(OH)2 → CaCO3↓ + H2O
– Theo bài ra, và PTPƯ ta có:
nCO2 = nCaCO3 = 5/100 = 0,05 (mol).
– Áp dụng định luật bảo toàn nguên tố C ta có: nCO = nCO2 = 0,05 (mol).
– Áp dụng định luật bảo toàn khối lượng ta có: mOxit + mCO = mKL + mCO2
⇒ mOxit = 2,32 + 0,05.44 – 0,05.28 = 3,12 (g).
IV. Bài tập muối Cacbonat tác dụng với dung dịch axit
* Phương pháp giải:
– Khi cho từ từ dung dịch axit vào dung dịch muối cacbonat ( hoặc hỗn hợp muối cacbonat và hiđrocacbonat) thì phản ứng xảy ra theo thứ tự sau:
CO32- + H+ → HCO3–
HCO3– + H+ → CO2 ↑ + H2O
– Khi cho từ từ dung dịch muối cacbonat ( hoặc hỗn hợp muối cacbonat và hiđrocacbonat) vào dung dịch axit thì phản ứng xảy ra đồng thời như sau:
CO32- + 2H+ → CO2 ↑ + H2O
HCO3– + H+ → CO2 ↑ + H2O
– Khi cho muối hidrocacbonat tác dụng với dung dịch bazo sẽ tạo ra muối cacbonat
HCO3– + OH– → CO32- + H2O
– Các muối cacbonat (trừ kim loại kiềm) và hidrocacbonat có phản ứng nhiệt phân.
* Ví dụ 1: Hòa tan hoàn toàn 20,6 gam hỗn hợp gồm Na2CO3 và CaCO3 bằng dung dịch HCl dư, thu được V lít khí CO2 (đktc) và dung dịch chứa 22,8 gam hỗn hợp muối. Tính giá trị của V?
* Lời giải:
– Gọi x, y lần lượt là số mol của natri cacbonat và canxi cacbonat.
– Theo bài ra ta có: mhh = mNa2CO3 + mCaCO3 = 106x + 100y = 20,6 (1)
– Áp dụng định luật bảo toàn nguyên tố Na, ta có:
nNaCl = 2nNa2CO3 = 2x (mol)
– Áp dụng định luật bảo toàn nguyên tố Ca, ta có:
nCaCl2 = nCaCO3 = y (mol)
– Nên có: mmuối = mNaCl + mCaCl2 = 58,5.2x + 111y = 22,8 (2)
– Ta giải hệ từ (1) và (2) được: x = 0,1 và y = 0,1
– Áp dụng định luật bảo toàn nguyên tố C, ta có:
nCO2 = nNa2CO3 + nCaCO3 = 0,1 + 0,1 = 0,2 (mol).
⇒ Thể tích khí CO2 thu được là: V = 0,2.22,4 = 4,48 (lít).
* Ví dụ 2: Cho 115,3 gam hỗn hợp 2 muối MgCO3 và RCO3 vào dung dịch H2SO4 loãng, thu được 4,48 lít khí CO2 (đktc), chất rắn X và dung dịch Y chứa 12 gam muối. Nung X đến khối lượng không đổi, thu được chất rắn Z và 11,2 lít khí CO2 (đktc). Tính khối lượng của Z.
* Lời giải:
– Theo bài ra, ta có: nCO2 = 4,48/22,4 = 0,2(mol).
– Phương trình phản ứng:
CO32- + 2H+ → CO2 + H2O
– Ta có nH2SO4 = nCO2 = nH2O = 0,2 (mol).
– Áp dụng định luật bảo toàn khối lượng, ta có:
mmuối (ban đầu) + mH2SO4 = mmuối (mới) + mCO2 + mX + mH2O
⇒ 115,3 + 0,2.98 = 12 + mX + 0,2.44 + 0,2.18
⇒ mX = 110,5 g
– Lại có: X → Z + 0,5 mol CO2
– Áp dụng định luật bảo toàn khối lượng, ta có:
mZ = mX – mCO2 = 110,5 – 0,5.44 = 88,5(g).
V. Bài tập nhiệt phân muối cacbonat
– Hầu hết các muối cacbonat đều không tan (trừ muối của Na, K và NH4)
– Các muối hidrocacbonat đều tan
* Ví dụ 1: Có hỗn hợp A gồm 3 muối NH4HCO3, NaHCO3 và Ca(HCO3)2. Khi nung 48,8 gam hỗn hợp đó đến khối lượng không đổi thu được 16,2 chất rắn X. Cho X tác dụng với dung dịch axít HCl thu được 2,24 lít (đktc) khí. Xác định khối lượng của mỗi muối trong hỗn hợp A.
* Lời giải:
– Gọi x, y, z lần lượt là số mol của NH4HCO3, NaHCO3 và Ca(HCO3)2
– Như vậy, theo bài ra, ta có: 79x + 84y + 162z = 48,8 (*)
– Các phương trình hóa học:
NH4HCO3 → NH3 + CO2 ↑ + H2O
2NaHCO3 → Na2CO3 + CO2↑ + H2O
y y/2
Ca(HCO3)2 → CaO + 2CO2↑+ H2O
z (mol) z
⇒ Chất rắn X gồm: Na2CO3, CaO, theo bài ra thu được 16,2 (g) nên có:
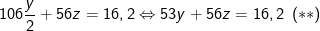
– Phương trình phản ứng khi X tác dụng với HCl:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
y/2 y
CaO + 2HCl → CaCl2 + H2O
– Theo bài ra, khi X tác dụng HCl thu được 2,24 lít khí chính là CO2, nên có
nCO2 = 2,24/22,4 = 0,1(mol) ⇒ nNaHCO3 = y = 0,1(mol). (***)
– Từ (*), (**) và (***) ta có : y = 0,1; x = 0,1115 và z = 0,1946
– Khối lượng mỗi muối trong hỗn hợp A là:
mNH4HCO3 = 0,1115.79 = 8,8 (g).
mNaHCO3 = 0,1.84 = 8,4 (g).
mCa(HCO3)2 = 0,1946.162 = 31,525 (g).
* Ví dụ 2: Nung 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khi khối lượng hỗn hợp không đổi được 69 gam chất rắn. Phần trăm khối lượng của mỗi chất tương ứng trong hỗn hợp ban đầu là bao nhiêu?
* Lời giải:
– Chỉ có NaHCO3 bị phân hủy. Đặt x là số mol NaHCO3
2NaHCO3 ![xrightarrow[]{t^0}](https://tmdl.edu.vn/wp-content/uploads/2023/03/16050799841xnwhu3l1y.gif) Na2CO3 + CO2↑ + H2O (1)
Na2CO3 + CO2↑ + H2O (1)
x 0,5x
– Theo PTPƯ và theo giả thiết ta có:
84x – 106.0,5x = 100 – 69 ⇒ x = 1(mol)
⇒ mNaHCO3 = 1.84 = 84(g) ⇒ mNa2CO3 = 100 – 84 = 16(g)
⇒ Vậy NaHCO3 chiếm 84% và Na2CO3 chiếm 16%.
Như vậy với việc vận dụng tính chất hóa học của cacbon để giải một số bài tập về các bon, các oxit của cacbon và hợp chất cacbon ở trên, Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoáhy vọng sẽ giúp ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại bình luận dưới bài viết để được ghi nhận và hỗ trợ, chúc các em học tốt.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/bai-tap-cac-bon-cac-oxit-cua-cac-bon-va-hop-chat-cua-cac-bon-hoa-lop-11/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





