Ở những bài học trước các em đã biết tính chất hóa học của Sắt Fe và các hợp chất của sắt như sắt oxit, sắt hidroxit, muối sắt. Đồng thời biết được sắt thường có số oxi hóa là +2, +3.
Trong bài này chúng ta cùng ôn tập lại các tính chất hóa học của sắt, các hợp chất của sắt (II) và sắt (III), và quan trọng hơn là luyện kỹ năng giải các bài tập về sắt và các hợp chất của sắt.
Bạn đang xem bài: Bài tập luyện tập về Sắt Fe và hợp chất của Sắt (II) Sắt (III) – Hóa 12 bài 37
I. Kiến thức cần nhớ về sắt và hợp chất
1. Sắt
– Nguyên tử Fe có cấu hình electron: [Ar] 3d64s2.
– Trong hợp chất, sắt dễ nhường electron, thể hiện số oxi hóa +2 và +3.
2. Hợp chất của sắt
– Tính chất hóa học đặc trưng của hợp chất sắt (II) là tính khử:
Fe2+ + 1e → Fe3+
– Tính chất hóa học đặc trưng của hợp chất sắt (III) là tính oxi hóa:
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
3. Hợp kim của sắt
– Thành phần của gang thép
– Các phản ứng chính xảy ra trong quá trình luyện gang.
II. Bài tập về sắt và hợp chất của sắt
* Bài 1 trang 165 SGK Hóa 12: Điền công thức hóa học của chất vào những chỗ trống và lập các phương trình hóa học sau:
a) Fe + H2SO4(đặc) 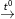 SO2 + …
SO2 + …
b) Fe + HNO3(đặc) 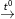 NO2 + …
NO2 + …
c) Fe + HNO3(loãng) → NO + …
d) FeS + HNO3 → NO + Fe2(SO4)3 + …
° Lời giải bài 1 trang 165 SGK Hóa 12:
– Các PTPƯ như sau:
a) 2Fe + 6H2SO4(đặc) 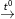 3SO2 + Fe2(SO4)3 + 6H2O
3SO2 + Fe2(SO4)3 + 6H2O
b) Fe + 6HNO3(đặc) 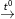 3NO2 + Fe(NO3)3 + 3H2O
3NO2 + Fe(NO3)3 + 3H2O
c) Fe + 4HNO3(loãng) → NO + Fe(NO3)3 + 2H2O
d) 3FeS + 12HNO3 → 9NO + Fe2(SO4)3 + Fe(NO3)3 + 6H2O
* Bài 2 trang 165 SGK Hóa 12: Bằng phương pháp hóa học, hãy phân biệt 3 mẫu hợp kim sau: Al – Fe; Al – Cu ; Cu – Fe.
° Lời giải bài 2 trang 165 SGK Hóa 12:
– Cho dung dịch NaOH vào 3 mẫu hợp kim, mẫu thử nào có khí thoát ra là Al-Fe và Al-Cu, mẫu thử nào không có khí thoát ra là Cu-Fe
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
– Cho dung dịch HCl đến dư vào hai mẫu thử trên, mẫu thử nào không hòa tan hết là Al-Cu, mẫu thử nào tan hết là Al-Fe
2Al + 6HCl → 2AlCl3 + 3H2↑
Fe + 2HCl → FeCl2 + H2↑
* Bài 3 trang 165 SGK Hóa 12: Một hỗn hợp bột gồm Al, Fe, Cu, Hãy trình bày một phương pháp hóa học để tách từng kim loại ra khỏi hỗn hợp đó. Viết các phương trình hóa học của các phản ứng.
° Lời giải bài 3 trang 165 SGK Hóa 12:
– Cho dung dịch NaOH dư vào hỗn hợp 3 kim loại thu được hai phần.
– Phần dung dịch là NaAlO2 và NaOH dư
– Phần chất rắn là Cu và Fe
Al + NaOH + H2O → NaAlO2 + (3/2)H2
– Lấy phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được chất rắn là Al2O3. Điện phân nóng chảy Al2O3 ta được Al.
NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3↓trắng keo
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
2Al(OH)3 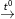 Al2O3 + 3H2O
Al2O3 + 3H2O
2Al2O3 ![small xrightarrow[]{dpnc} 1576643508soodw62n19 1639482595 1](https://tmdl.edu.vn/wp-content/uploads/2022/12/1576643508soodw62n19_1639482595-1.gif) 4Al + 3O2
4Al + 3O2
– Phần chất rắn đem hòa tan trong HCl dư, thu được dung dịch là FeCl2, còn phần chất rắn là Cu. Điện phân dung dịch thu được ta được Fe.
Fe + 2HCl → FeCl2 + H2↑
FeCl2 ![small xrightarrow[]{dpdd} 1576643510412uk1s2ir 1639482596 1](https://tmdl.edu.vn/wp-content/uploads/2022/12/1576643510412uk1s2ir_1639482596-1.gif) Fe + Cl2↑
Fe + Cl2↑
* Bài 4 trang 165 SGK Hóa 12: Cho một ít bột sắt nguyên chất tác dụng hết với dung dịch H2SO4 loãng thu được 560 ml một chất khí ở đktc. Nếu cho một lượng gấp đôi bột sắt nói trên tác dụng hết với dung dịch CuSO4 thì thu được một chất rắn. Tính khối lượng bột sắt đã dùng trong hai trường hợp nói trên và khối lượng chất rắn thu được.
° Lời giải bài 4 trang 165 SGK Hóa 12:
◊ Theo bài ra, thu được 560 ml một chất khí ở đktc khi Fe tác dụng H2SO4 nên có:

– Phương trình phản ứng:
Fe + H2SO4 → FeSO4 + H2↑
– Theo PTPƯ thì: nFe = nH2 = 0,025(mol)
⇒ Khối lượng sắt dùng ở trường hợp này là: mFe = 0,025.56 = 1,4(g)
◊ Cho lượng Fe gấp đôi tác dụng CuSO4, khi đó số mol Fe là: 0,025.2 = 0,05 (mol)
– Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu↓
nFe = 0,05 mol.
– Khối lượng Fe đã dùng ở trường hợp này là: mFe = 0,05.56 = 2,8 (g)
– Khối lượng chất rắn thu được là: mCu = 0,05.64 = 3,2(g).
* Bài 5 trang 165 SGK Hóa 12: Biết 2,3 gam hỗn hợp gồm MgO, CuO, FeO tác dụng vừa đủ với 100ml dung dịch H2SO4 0,2M. Khối lượng muối thu được là:
A. 3,6 gam. B. 3,7 gam. C. 3,8 gam. D. 3,9 gam.
° Lời giải bài 5 trang 165 SGK Hóa 12:
• Chọn đáp án: D. 3,9 gam.
– Theo bài ra, hỗn hợp tác dụng vừa đủ với 100ml dung dịch H2SO4 0,2M nên:
nH2SO4 = 0,1. 0,2 = 0,02 (mol).
– Gọi công thức chung của hỗn hợp là MO, ta có PTPƯ:
MO + H2SO4 → MSO4 + H2O
– Theo PTPƯ và theo định luật bảo toàn nguyên tố
⇒ nO (trong oxit) = nH2SO4= 0,02 (mol)
⇒ mKL = m(oxit) – mO(trong oxit) = 2,3 – 0,02.16 = 1,98 (g).
– Khối lượng muối tạo thành:
mmuối 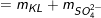 = 1,98 + 0,02.96 = 3,9 (g).
= 1,98 + 0,02.96 = 3,9 (g).
* Bài 6 trang 165 SGK Hóa 12: Nguyên tử của nguyên tố X có tổng số hạt cơ bản (p,n,e) là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Nguyên tố X là nguyên tố nào?
A. Sắt. B. Brom. C. Photpho. D. Crom.
° Lời giải bài 6 trang 165 SGK Hóa 12:
• Chọn đáp án: A. Sắt.
– Gọi p, n, e lần lượt là số proton, notron và electron, ta có:
p + n + e = 82.
p + e – n = 22.
– Mà p = e ⇒ 2p + n =82
2p – n = 22
⇒ p = e = 26; n = 30. ⇒ nguyên tố X là Fe.
Hy vọng với bài viết về Bài tập luyện tập về Sắt Fe và hợp chất của Sắt (II) Sắt (III) ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Tmdl.edu.vn (tmdl.edu.vn)
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




