Oxit Axit và Oxit bazơ là những chất hóa học quan trọng, tham gia vào rất nhiều quá trình phản ứng khi các em học hóa học vô cơ, vì vậy đây là nội dung mà các em nên dành nhiều thời gian để học thật kỹ.
Nội dung bài viết này chúng ta sẽ cùng ôn lại một số kiến thức về Oxit, hệ thống lại các dạng bài tập về Oxit axit tác dụng với dung dịch kiểm, và ngược lại bài tập Oxit bazơ tác dụng với dung dịch axit để các em hiểu rõ hơn.
Bạn đang xem bài: Bài tập về Oxit axit tác dụng dunh dịch kiềm, Oxit bazơ tác dụng với Axit – Hóa 9 chuyên đề
I. Kiến thức cần nhớ về Oxit, phân loại oxit
1. Oxit bazơ là những oxit tác dụng với dung dịch axit tạo thành muối và nước.
* Ví dụ: Na2O, BaO, MgO,…
2. Oxit axit là những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
* Ví dụ: CO2, SO2, SO3,…
3. Oxit lưỡng tính là những oxit tác dụng với dung dịch axit và tác dụng với dung dịch bazơ tạo thành muối và nước.
* Ví dụ: Al2O3, ZnO, SnO, PbO
4. Oxit trung tính hay còn gọi là oxit không tạo muối là những oxit không tác dụng với axit, bazơ, nước
* Ví dụ: CO, NO,…
II. Các dạng bài tập Oxit
° Dạng 1: Bài toán Oxit bazơ tác dụng với dung dịch axit
* Phương pháp giải:
Để giải bài tập dạng này ta thực hiện các bước sau:
– Bước 1: Viết phương trình phản ứng: Oxit bazo + axit → muối + H2O
* Ví dụ: CaO + HCl → CaCl2 + H2O
Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O
– Bước 2: Xác định số mol lượng chất đề bài cho sẵn
– Bước 3: Từ phương trình hóa học, áp dụng thêm một số định luật khác như: bảo toàn khối lượng, bảo toàn nguyên tố để giải quyết yêu cầu của đề bài
* Bài tập 1: Hòa tan vừa đủ 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là bao nhiêu?
Xem lời giải
• Đề bài: Hòa tan vừa đủ 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là bao nhiêu?
• Lời giải:
– Theo bài ra, ta có: nCaO = m/M = 5,6/56 = 0,1 (mol).
– PTHH: CaO + 2HCl → CaCl2 + H2O
1 mol 2mol
0,1 mol → x mol
– Theo PTPƯ ta có nHCl = 2nCaO = 2.0,1 = 0,2(mol)
⇒ mHCl = n.M = 0,2.36,5 = 7,3 (g)
Từ công thức: 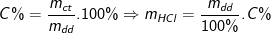
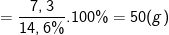
⇒ Khối lượng dung dịch HCl đã dùng là 50(g).
* Bài tập 2: Hòa tan hoàn toàn 10 gam MgO cần dùng vừa đủ 400 ml dung dịch HCl aM thu được dung dịch X. Giá trị của a là bao nhiêu?
Xem lời giải
• Đề bài: Hòa tan hoàn toàn 10 gam MgO cần dùng vừa đủ 400 ml dung dịch HCl aM thu được dung dịch X. Giá trị của a là bao nhiêu?
• Lời giải:
– Theo bài ra, ta có: nMgO = m/M = 10/40 = 0,25 (mol).
– PTHH: MgO + 2HCl → MgCl2 + H2O
1 mol 2mol
0,25 → x? mol
⇒ Theo PTPƯ: nHCl = 2nMgO = 2.0,25 = 0,5(mol).
– Nồng độ của dung dịch HCl là: 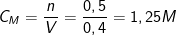
* Bài tập 3: Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là bao nhiêu?
Xem lời giải
° Dạng 2: Bài toán Oxit axit tác dụng với dung dịch kiềm
– Dung dịch kiềm là dung dịch bazo tan gồm có: NaOH, KOH, Ba(OH)2, Ca(OH)2,…
* Phương pháp giải:
Tương tự như dạng 1, ta thực hiện các bước sau:
– Bước 1: Viết PTHH: Oxit axit + dung dịch kiềm ⇒ muối + H2O
*Ví dụ: CO2 + Ca(OH)2 → H2O + CaCO3↓
– Bước 2: Xác định số mol lượng chất đề bài cho sẵn
– Bước 3: Từ phương trình hóa học, áp dụng thêm một số định luật khác như: bảo toàn khối lượng, bảo toàn nguyên tố để giải quyết yêu cầu của đề bài
* Bài tập 1: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là bao nhiêu?
Xem lời giải
• Đề bài: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là bao nhiêu?
• Lời giải:
– Theo bài ra: ta có: nCO2 = V/22,4 = 1,68/22,4 = 0,075 (mol).
– Vì KOH dư nên phản ứng tạo ra muối trung hòa
CO2 + 2KOH → K2CO3 + H2O
1mol 1mol
0,075 → x?mol
– Theo PTPƯ: nK2CO3 = nCO2 = 0,075(mol)
– Vì thể tích dung dịch trước và sau không thay đổi ⇒ Vdd = 250 ml = 0,25 lít
⇒ Nồng độ muối thu được sau phản ứng là: 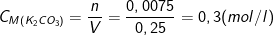
* Bài tập 2: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là bao nhiêu?
Xem lời giải
• Đề bài: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là bao nhiêu?
• Lời giải:
– Theo bài ra, ta có: VBa(OH)2 = 400(ml) = 0,4(l).
⇒ nBa(OH)2 = CM.V = = 0,1.0,4 = 0,04 (mol).
– Có PTPƯ:
SO2 + Ba(OH)2 → BaSO3 + H2O
1(mol) 1(mol)
x?mol 0,04 mol
– Theo PTPƯ: nSO2= nBa(OH)2 = 0,04 (mol).
⇒ VSO2 = nCO2.22,4 = 0,04 . 22,4 = 0,896(lít).
° Dạng 3: Bài toán giữa các Oxit
* Phương pháp giải:
Vận dụng các phương trình phản ứng:
– Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit.
* Ví dụ: SO3 + H2O → H2SO4
– Một số oxit bazơ tác dụng với nước tạo thành dung dịch bazơ (kiềm).
* Ví dụ: Na2O + H2O → 2NaOH
– Oxit axit tác dụng với một số oxit bazơ (tan) tạo thành muối.
* Ví dụ: CO2 + BaO → BaCO3
* Bài tập 1: Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là bao nhiêu?
Xem lời giải
• Đề bài: Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là bao nhiêu?
• Lời giải:
– Theo bài ta, ta có: nSO3 = 8/80 = 0,1(mol).
– Có PTHH:
SO3 + H2O → H2SO4
1(mol) 1mol
0,1 → x? mol
– Theo PTPƯ thì nH2SO4 = nSO3 = 0,1 (mol).
⇒ Nồng độ mol của dd axit sunfuric H2SO4 thu dược là:
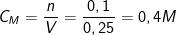
* Bài tập 2: Cho 20 gam hỗn hợp Na2O và CuO tác dụng hết với 3,36 lít SO2(đktc). Sau phản ứng thấy thu được một chất rắn không tan. Thành phần phần trăm theo khối lượng của 2 oxit trong hỗn hợp lần lượt là bao nhiêu?
Xem lời giải
Như vậy, với 3 dạng toán điểm hình: Oxit axit tác dụng với dụng dịch kiểm, Oxit bazo tác dụng với dung dịch axit và bài tập phản ứng giữa các oxit với nhau. Hy vọng các em sẽ hiểu rõ và vận dụng tốt để chuẩn bị cho các bài học tiếp theo.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
tmdl.edu.vn. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/bai-tap-ve-oxit-axit-tac-dung-dunh-dich-kiem/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





