Nếu như đã làm quen với bài tập về oxit axit tác dụng với dụng dịch kiềm hay oxit bazo tác dụng với axit thì nội dung phần bài tập SO2, CO2 tác dụng với các dung dịch kiềm như NaOH, Ca(OH)2, Ba(OH)2 cũng sẽ không quá khó.
Ngoài dạng bài tập trắc nghiệm các câu hỏi lý thuyết về tính chất hóa học, bài viết này chúng ta tập trung vào dạng bài tập tính toán định lượng khi SO2, CO2 tác dụng với các dung dịch kiềm như NaOH, Ca(OH)2, Ba(OH)2,…
Bạn đang xem bài: Bài tập về SO2, CO2 tác dụng với dung dịch kiềm NaOH, Ca(OH)2 – Hóa 9 chuyên đề
– Thực tế đối với dạng bài tâp về Oxit axit (như SO2, CO2) tác dụng với dung dịch kiềm (như NaOH, Ca(OH)2, Ba(OH)2) chúng ta cần phải lập tỉ lệ mol, cụ thể như sau:
* Phản ứng của SO2 khi tác dụng với dung dịch NaOH:
SO2 + NaOH → NaHSO3 (1)
1 1
SO2 + 2NaOH → Na2SO3 + H2O (2)
1 2
• Ta lập tỉ lệ: 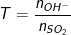
> Lưu ý:
+ Nếu bazơ là NaOH, KOH thì nOH– = nNaOH; nOH– = nKOH;
+ Nếu bazơ là Ca(OH)2, Ba(OH)2 thì nOH– = 2nCa(OH)2 ; nOH– = 2nBa(OH)2
• Xét giá trị của T:
– Nếu T ≤ 1 ⇒ Chỉ xảy ra phản ứng (1) diễn ra ⇒ Sản phẩm sinh ra chỉ có muối NaHSO3 và có thể có SO2 dư
– Nếu T ≥ 2 ⇒ Chỉ xảy ra phản ứng (2) diễn ra ⇒ Sản phẩm sinh ra chỉ có muối Na2SO3 và có thể có NaOH dư
– Nếu 1 < T < 2 ⇒ Xảy ra cả 2 phản ứng (1), (2) đều diễn ra ⇒ Sản phẩm sinh ra có cả 2 muối NaHSO3, Na2SO3.
* Bài toán CO2 hay SO2 tác dụng với dung dịch Ca(OH)2, Ba(OH)2
2CO2 + Ca(OH)2 → Ca(HCO3)2 (1)
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
• Ta lập tỉ lệ: 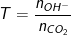
• Xét giá trị của T:
– Nếu T ≤ 1: Chỉ xảy ra phản ứng (1) ⇒ Sản phẩm sinh ra chỉ có muối Ca(HCO3)2 và có thể có CO2 dư
– Nếu T ≥ 2 ⇒ Chỉ xảy ra phản ứng (2) ⇒ Sản phẩm sinh ra chỉ có muối CaCO3 và có thể có Ca(OH)2 dư
– Nếu 1 < T < 2 ⇒ Xảy ra cả 2 phản ứng (1), (2) ⇒ Sản phẩm sinh ra có cả 2 muối Ca(HCO3)2, CaCO3.
* Bài tập về CO2, SO2 tác dụng với dung dịch kiềm NaOH, Ca(OH)2,…
* Bài tập 1: Dẫn 112ml khí SO2 (đktc) đi qua 700ml dung dịch Ca(OH)2 có nồng độ 0,01 M, sản phẩm là muối canxi sunfit.
a) Viết phương trình phản ứng hóa học.
b) Tính khối lượng các chất sau phản ứng.
Xem lời giải
• Đề bài: Dẫn 112ml khí SO2 (đktc) đi qua 700ml dung dịch Ca(OH)2 có nồng độ 0,01 M, sản phẩm là muối canxi sunfit.
a) Viết phương trình phản ứng hóa học.
b) Tính khối lượng các chất sau phản ứng.
• Lời giải:
– Theo bài ra ta có: VSO2 = 112(ml) = 0,112 (l); Vdd Ca(OH)2 = 700(ml) = 0,7(l).
⇒ nSO2 = V/22,4 = 0,112/22,4 = 0,005 (mol).
Từ công thức: CM = n/V suy ra nCa(OH)2 = CM.Vdd Ca(OH)2 = 0,7.0,01 = 0,007 (mol).
⇒ nOH = 2nCa(OH)2 = 2.0,007 =0,014(mol).
a) Phương trình phản ứng:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
1 mol 1 mol 1 mol 1 mol
b) Theo PTPƯ và theo bài ra, ta có:
– Ta lập tỉ lệ: 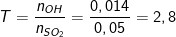
– Xét giá trị của T, thấy T>2 nên chỉ xảy ra phản ứng tạo muối CaSO3
(tức là: SO2 hết Ca(OH)2 dư; Các chất sau phản ứng là Ca(OH)2 và CaSO3)
– Theo PTPƯ: nCa(OH)2 = nSO2 = 0,005 (mol).
⇒ nCa(OH)2(dư) = 0,007 – 0,005 = 0,002 (mol).
⇒ mCa(OH)2(dư) = n.M = 0,002.74 = 0,148 (g).
⇒ nCaSO3 = nSO2 = 0,005 (mol)
⇒ mCaSO3 = n.M = 0,005.120 = 0,6 (g).
– Vậy khối lượng các chất sau phả ứng là: Ca(OH)2(dư) = 0,148(g); CaSO3 = 0,6(g).
* Bài tập 2: Dẫn 448 ml CO2 (đktc) sục vào bình chứa 100 ml dung dịch NaOH 0,25M. Khối lượng hai muối tạo thành là bao nhiêu?
Xem lời giải
* Bài tập 3: Dẫn 1,12 lít khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M. Khối lượng của muối thu được sau phản ứng là bao nhiêu?
Xem lời giải
• Đề bài: Dẫn 1,12 lít khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M. Khối lượng của muối thu được sau phản ứng là bao nhiêu?
• Lời giải:
– Ta có: VCa(OH)2 = 700(ml) =0,7(l); CM(Ca(OH)2) = 0,1M
Từ công thức CM = n/V suy ra: nCa(OH)2 = CM.V = 0,1. 0,7 = 0,07(mol).
⇒ 0,07 mol Ca(OH)2 có chứa 0,14 mol OH
– Từ công thức (khí ở đktc): n = V/22,4 suy ra nSO2 = 1,12/22,4 = 0,05(mol)
– Ta lập tỉ lệ: 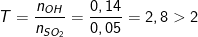
⇒ Sản phẩm sau phản ứng chỉ có muối CaSO3 và Ca(OH)2 dư, ta có PTPƯ:
SO2 + Ca(OH)2 → CaSO3 + H2O
0,05(mol) → 0,05 → 0,05
⇒ mCaSO3 = 0,05.120 = 6(g).
– Kết luận: Khối lượng muối CaSO3 thu được sau phản ứng là 6 gam.
* Bài tập 4: Cho 4,48 lít CO2 (đktc) đi qua 190,48ml dung dịch NaOH 2% có khối lượng riêng là 1,05g/ml. Khối lượng muối tạo thành là bao nhiêu?
Xem lời giải
Như vậy các em thấy để hiểu và làm được dạng toán này các em cần nắm vững được tính chất hóa học (các phương trình phản ứng – PTPƯ) của oxit, lập tỉ lệ số mol và xét giá trị của tỉ lệ này để xác định có PTPƯ nào xảy ra, từ đó mới giải được bài toán. Đây là dạng toán quan trọng mà các em sẽ còn gặp ở bậc THPT và thường xuất hiện trong đề thi tốt nghiêp THPT quốc gia.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/bai-tap-ve-so2-co2-tac-dung-voi-dung-dich-kiem-naoh-caoh2/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




