Như các em đã biết nước là chất điện li rất yếu, và dựa vào độ PH của [H+] và [OH–] người ta biết được đó là môi trường axit, môi trường kiềm hay môi trường trung tính.
Bài viết này chúng ta cùng ôn lại một số nội dung về sự điện li của nước, ph và cách giải các dạng bài tập cơ bản vận dụng kiến thức này.
Bạn đang xem bài: Bài tập về sự điện li của nước, PH và cách giải – Hóa 11 chuyên đề
° Dạng 1: Sự điện li của nước và PH
* Phương pháp giải: Vận dụng kiến thức sau
– Nước là chất điện li rất yếu : H2O ⇌ H+ + OH–
– Tích số ion của nước: = [H+][OH–] =10-14 M (đo ở 25oC)
• Môi trường axit:
[H+] > [OH–] hay [H+] > 1,0.10–7M ⇒ pH < 7
• Môi trường kiềm:
[H+] < [OH–] hay [H+] < 1,0.10–7M ⇒ pH > 7
• Môi trường trung tính :
[H+] = [OH–] = 1,0.10–7M ⇒ pH = 7
* Ví dụ 1: Một dung dịch có [OH– ]= 1,5.10-5. Môi trường của dung dịch này là:
A. Axit ; B. Trung tính ; C. Kiềm; D. Không xác định được
* Hướng dẫn và đáp án:
– Đáp án: C. Kiềm
– Bài ra: [OH–]= 1,5.10-5 (M) mà [H+][OH–] =10-14(M) nên ta có:
![[H^+]=frac{10^{-14}}{1,5.10^{-5}}=6,7.10^{-10}(M)<10^{-7}(M) 1601184757bxofw7c5tz 1601187002 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1601184757bxofw7c5tz_1601187002-1.gif)
⇒ Môi trường có tính chất kiềm
* Ví dụ 2: Cho các muối sau: NaNO3 ; K2CO3 ; CuSO4 ; FeCl3 ; AlCl3 ; KCl. Các dung dịch nào có pH = 7:
A. NaNO3 ; KCl.
B. K2CO3 ; CuSO4 ; KCl.
C. CuSO4 ; FeCl3 ; AlCl3.
D. NaNO3 ; K2CO3 ; CuSO4.
* Hướng dẫn và đáp án:
– Dung dịch có môi trường trung tính sẽ có pH = 7. Mặt khác, muối có môi trường trung tính là muối của kim loại mạnh và gốc axit mạnh.
⇒ Đáp án là: A. NaNO3 ; KCl.
* Ví dụ 3: Cho phản ứng :
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
Hấp thụ hết a mol NO2 vào dung dịch chứa a mol NaOH thì dung dịch thu được có giá trị
A. pH = 7. B. pH > 7. C. pH = 0. D. pH < 7.
* Hướng dẫn và đáp án:
– Theo PTPƯ và theo bài ra, ta thấy nNO2 = nNaOH nên 2 chất phản ứng hết.
– Mặt khác, sau phản ứng sinh ra NaNO3 có môi trường trung tính và NaNO2 có môi trường bazo (do là muối của kim loại mạnh và axit yếu).
→ Nên sau phản ứng dung dịch thu được có môi trường bazo ⇒ Đáp án là B. pH > 7.
° Dạng 2: Tính độ pH của axit và bazơ mạnh
* Phương pháp giải:
– Tính số mol H+, OH– có trong dung dịch
– Nồng độ H+ và OH– có trong dung dịch
→ Từ đó suy ra độ pH và kết luận
* Ví dụ 1: Tính nồng độ H+, OH– và pH của dung dịch HCl 0,10M và dung dịch NaOH 0,010M?
* Hướng dẫn và đáp án:
+ Với dung dich HCl 0,1M:
HCl → H+ + Cl–
0,1 0,1 0,1(M)
⇒ [H+] = 0,1M = 10-1M ⇒ pH=1.
+ Với dung dich NaOH 0,01M:
NaOH → Na+ + OH–
0,01 0,01 0,01(M)
⇒ [OH–] = 0,01M = 10-2M. Mặt khác có, [H+][OH–] =10-14 M
![Rightarrow [H^+]=frac{10^{-14}}{[OH^-]}=frac{10^{-14}}{10^{-2}}=10^{-12}MRightarrow pH=12](https://tmdl.edu.vn/wp-content/uploads/2023/03/1601184761q8xqksmrsb_1601187003.gif)
* Ví dụ 2: Trộn 10g dung dịch HCl 7,3% với 20g dung dịch H2SO4 4,9% rồi thêm nước để được 100ml dung dịch A. Tính pH của dung dịch A.
* Hướng dẫn và đáp án:
– Theo bài ra, ta có:
Từ công thức: C% = (mct/mdd).100% ⇒ mHCl = 10.7,3% = 0,73(g)
⇒ nHCl = 0,73/36,5 = 0,02 (mol)
Tương tự: mH2SO4 = 20.4,9% = 0,98 (g)
⇒ nH2SO4 = 0,98/98 = 0,01 (mol).
– Ta có phương trình điện li như sau:
HCl → H+ + Cl–
0,02 0,02
H2SO4 → 2H+ + SO42-
0,01 0,02
⇒ nH+ = 0,02 + 0,02 = 0,04 (mol)
– Lại có, V dung dịch sau khi pha trộn là 100ml = 0,1 lít
⇒ CM[H+] = n/V = 0,04/0,1 = 0,4(M)
⇒ pH = 0,4.
* Ví dụ 2: Hoà tan 3,66 gam hỗn hợp Na, Ba vào nước dư thu được 800ml dung dịch A và 0,896 lít H2 (đktc). Tính pH của dung dịch A.
* Hướng dẫn và đáp án:
– Theo bài ra, nH2 = 0,896/22,4 = 0,04(mol)
– Gọi số mol của Na và Ba lần lượt là x, y mol.
Ta có: 23x + 137y = 3,66 (1)
– Các phương trình phản ứng:
Na + H2O → NaOH + 1/2H2
x → x x/2 mol
Ba + 2H2O → Ba(OH)2 + H2
y → y → y mol
– Từ PTPƯ và bài ra: nH2 = x/2 + y = 0,04 (2)
– Giải hệ từ (1), (2) ta có: x = 0,04 và y = 0,02
– Phương trình điện ly:
NaOH → Na+ + OH–
0,04 0,04 mol
Ba(OH)2 → Ba2+ + 2OH–
0,02 0,04 mol
– Từ PT điện li tổng số mol OH– là: ∑nOH– = 0,04 + 0,04 = 0,08(mol)
⇒ CM(OH–) = n/V = 0,08/0,8 = 0,1(M)⇒ pOH = 1 ⇒ pH = 13
* Ví dụ 3: Hòa tan 4,9 mg H2SO4 vào nước thu dược 1 lít dd. pH của dd thu được là bao nhiêu?
* Hướng dẫn và đáp án:
– Bài cho: m = 4,9mg = 4,9.10-3(g) =49.10-4(g)
– Theo bài ra, ta có: nH2SO4 = 49.10-4/98 = 0,5.10-4 mol
⇒ CM(H2SO4) = 5.10-5/1 = 5.10-5(M).
– Phương trình điện li:
H2SO4 → 2H+ + SO42-
0,5.10-4 2.0,5.10-4(mol)
⇒ CM(H+) = 10-4/1 = 10-4 ⇒ [H+] = 10-4 M
⇒ pH = -log[H+] = -log(10-4) = 4
* Ví dụ 4: Cho 15 ml dung dịch HNO3 có pH = 2 trung hòa hết 10 ml dung dịch Ba(OH)2 có pH = a. Tính giá trị của a?
* Hướng dẫn và đáp án:
– Bài cho Vdd HNO3 = 15ml = 15.10-3(l). pH=2;
Vdd Ba(OH)2 = 10ml = 10.10-3(l); pH = a; a=?
– Theo bài ra, ta có: pH = 2 ⇒ [H+] = 10-2 (M)
– Phương trình điện li: HNO3 → H+ + NO3–
⇒ CM(HNO3) = [H+] = 10-2M
⇒ nHNO3 = CM.V = 15.10-3.10.10-3 = 15.10-5 (mol)
– PTPƯ trung hòa HNO3 và Ba(OH)2:
H+ + OH– → H2O
⇒ nOH– = nH+ = 15.10-5 = 15.10-5(mol)
⇒ CM(OH–) = nOH–/Vdd Ba(OH)2 = 1,5.10-4/10-2 = 1,5.10-2M
⇒ pOH =-log[OH–] = 1,82 ⇒ pH = 14 – pOH = 14 – 1,82 = 12,18
→ Vậy a = 12,18.
* Ví dụ 5: Hoà tan m gam Zn vào 200 ml dung dịch H2SO4 0,4M thu được 1,568 lít khí hiđro và dung dịch X. Tính pH của dung dịch X?
* Hướng dẫn và đáp án:
– Theo bài ra, ta có: nH2SO4 =CM.V = 0,4.0,2 = 0,08 (mol)
nH2 = V/22,4 = 1,568/22,4 = 0,07 (mol)
– Ta có phương trình hóa học:
Zn + H2SO4 → ZnSO4 + H2↑ (1)
– Từ PTPƯ (1) ⇒ nH2SO4 pứ = nH2 = 0,07(mol).
⇒ n H2SO4 dư = 0,08 – 0,07 = 0,01 mol
– Ta có phương trình điện li:
H2SO4 → 2H+ + SO42-
0,01 0,02
⇒ [H+] = n/V = 0,02/0,2 = 0,1M ⇒ pH = -log[H+] = -log[10-1] = 1.
° Dạng 3: Xác định pH của axit và bazơ yếu
* Phương pháp giải:
+ Viết phương trình điện li
– Dựa vào dữ kiện đề bài áp dụng công thức tính độ điện li và hằng số điện li axit, bazo Ka, Kb
– Công thức tính độ điện li:
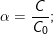 trong đó: C nồng độ chất điện li; C0 nồng độ chất tan
trong đó: C nồng độ chất điện li; C0 nồng độ chất tan
+ Ta có phương trình điện li của axit;
HA ⇌ A– + H+
![small K_a=frac{[H^+][A^-]}{[HA]}; 16011847707v19e6s0rk 1601187003](https://tmdl.edu.vn/wp-content/uploads/2023/03/16011847707v19e6s0rk_1601187003.gif) Ka chỉ phụ thuộc vào bản chất của axit và nhiệt độ
Ka chỉ phụ thuộc vào bản chất của axit và nhiệt độ
+ Ta có phương trình điện li của bazo:
BOH ⇌ B+ + OH–
![small K_b=frac{[B^+][OH^-]}{[BOH]}; 1601184774o5vu4rctp1 1601187003](https://tmdl.edu.vn/wp-content/uploads/2023/03/1601184774o5vu4rctp1_1601187003.gif) Kb chỉ phụ thuộc vào bản chất của axit và nhiệt độ
Kb chỉ phụ thuộc vào bản chất của axit và nhiệt độ
– Ngoài ra, ta có thể áp dụng được công thức tính nhanh như sau: 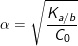
* Ví dụ 1: Giá trị pH của dung dịch axit fomic 1M (Ka = 1,77.10–4) là bao nhiêu?
* Hướng dẫn và đáp án:
– Phương trình điện li:
HCOOH ⇌ COO– + H+ (1)
![small K_a=frac{[H^+][HCOO^-]}{[HCOOH]} 1601184782ogb2og9m2e 1601187004](https://tmdl.edu.vn/wp-content/uploads/2023/03/1601184782ogb2og9m2e_1601187004.gif)
– Ban đầu: 1M
– Điện li:
a.1 ………. a.1 …….. a.1
– Sau điện li:
1– a……….. a ………. a
– Tại thời điểm cân bằng ta có :
![small K_a=frac{[H^+][A^-]}{[HA]}=frac{alpha ^2}{1-alpha }=1,77.10^{-4},: (2)](https://tmdl.edu.vn/wp-content/uploads/2023/03/1601184788mb0mh0wxp3_1601187004.gif)
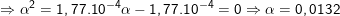
– Theo (1) thì [H+] = a = 0,0132M ⇒ pH = -lg[H+] = 1,88.
* Ví dụ 2: Dung dịch CH3COONa 0,1M (Kb = 5,71.10–10) có [H+] là bao nhiêu?
* Hướng dẫn và đáp án:
– Phương trình điện li:
CH3COONa → CH3COO– + Na+
CM : 0,1 → 0,1
– Phương trình phản ứng thủy phân:
CH3COO– + H2O ⇌ CH3COOH + OH–
CM : a.0,1 → a.0,1
– Ta có:![small K_b=frac{[CH_3COOH][OH^-]}{[CH_3COO^-]} 1601184803f36om6ycfi 1601187005](https://tmdl.edu.vn/wp-content/uploads/2023/03/1601184803f36om6ycfi_1601187005.gif)
– Sử dụng công thức 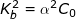 ta có:
ta có:
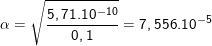
![small Rightarrow [OH^-]=alpha C_0=7,556.10^{-6} 16011848175va8bonfkl 1601187006](https://tmdl.edu.vn/wp-content/uploads/2023/03/16011848175va8bonfkl_1601187006.gif)
![small Rightarrow [H^+]=frac{10^{-14}}{7,556.10^{-6}}=1,32.10^{-9}M 16011848216kthv6yt40 1601187006](https://tmdl.edu.vn/wp-content/uploads/2023/03/16011848216kthv6yt40_1601187006.gif)
* Ví dụ 3: Dung dịch A chứa NH3 0,1M và NaOH 0,1M. Tính pH của dung dịch biết Kb của NH3 = 1,75.10-5.
* Hướng dẫn và đáp án:
– Ta có phương trình điện li:
NaOH → Na+ + OH–
0,1 0,1
NH3 + H2O ⇌ NH4+ + OH–
– Ban đầu NH3 là 0,1M và OH– là 0,1M
– Điện ly:
x x x
– Sau điện ly:
0,1- x x x+0,1
![small K_b=frac{[NH_{4}^{+}][OH^-]}{[NH_3]}=frac{x.(0,1+x)}{0,1-x}=1,75.10^{-5}](https://tmdl.edu.vn/wp-content/uploads/2023/03/16011848251yx9vo0mw5_1601187006.gif)
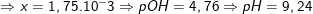
* Ví dụ 4: Hoà tan 1,07g NH4Cl vào nước được 2 lít dung dịch X.
a) Tính pH của dung dịch X biết hằng số phân li bazơ của NH3 là 1,8.10-5.
b) Nếu thêm vào dung dịch X 100 ml dd HCl 0,01M được dd Y. Tính pH của dd Y?
* Hướng dẫn và đáp án:
a) Ta có: nNH4Cl= m/M = 1,07/53,5 = 0,02
⇒ CM(NH4Cl) = n/V = 0,02/2 = 0,01M
– Phương trình điện li:
NH4Cl → NH4+ + Cl–
0,01 0,01
NH4+ + H2O ⇌ NH3 + H3O+
-Ban đầu: 0,01
– Điện ly:
x …………………….x………..x
– Sau điện ly:
0,01-x………..……x………. x
Kb = x2/(0,01-x) = 1,8.10-5
⇒ x = 4,24.10-4 ⇒ pH = 3,37
b) Phương trình điện ly:
HCl → H+ + Cl–
0,001 0,001
NH4+ + H2O ⇌ NH3 + H3O+
– Ban đầu:
0,01……………………….0,001
– Điện ly:
x…………………….x…………x
– Sau điện ly:
0,01-x…………… x………x+0,001
Kb = x(x+0,001)/(0,01-x) = 1,8.10-5
⇒ x = 3,69.10-4 ⇒ pH = 3,43.
° Dạng 4: Bài toán pha loãng các chất điện li để được pH định trước.
* Phương pháp giải:
+ Tính số mol axit, bazo
Viết phương trình điện li
– Tính tổng số mol H+, OH–
– Viết phương trình phản ứng trung hòa
– Xác định môi trường của dung dịch dựa vào pH ⇒ Xem xét mol axit hay bazơ dư ⇒ tìm các giá trị mà bài toán yêu cầu.
> Chú ý: Vdd sau khi trộn = Vaxit + Vbazo
* Ví dụ 1: Trộn 3 dung dịch H2SO4 0,1M ; HNO3 0,2M ; HCl 0,3M với thể tích bằng nhau thu được dung dịch A. Lấy 300 ml dung dịch A tác dụng với dung dịch B gồm NaOH 0,2M và Ba(OH)2 0,1M. Tính thể tích dung dịch B cần dùng để sau khi phản ứng kết thúc thu được dung dịch có pH = 1. Coi Ba(OH)2 và H2SO4 phân li hoàn toàn ở 2 nấc.
* Hướng dẫn và đáp án:
– Sau khi trộn 3 dung dịch axit có thể tích bằng nhau ta thu được nồng độ mới của 3 axit là: CM(HCl) = 0,1 M; CM(HNO3) = 0,2/3; CM(H2SO4) = 0,1/3. Trong 300 ml dung dịch A: nHCl = 0,03 mol; nH2SO4 = 0,01 mol; nHNO3 = 0,02 mol
– Phương trình điện ly:
H2SO4 → 2H+ + SO42-
0,01 0,02
HNO3 → H+ + NO3–
0,02 0,02
HCl → H+ + Cl–
0,03 0,03
– Tổng mol H+ là nH+ = 0,07 mol
– Gọi x là thể tích của dung dịch B cần dung.
nNaOH = 0,2x; nBa(OH)2 = 0,1x
– Phương trình điện ly:
NaOH → Na+ + OH–
0,2x 0,2x
Ba(OH)2 → Ba2+ + 2OH–
0,1x 0,2x
– Tổng số mol OH– là: nOH– = 0,4x
– Ta có: H+ + OH– → H2O (Sau phản ứng pH =1 ⇒ dư axit)
– Ban đầu: 0,07 0,4x
– PƯ: 0,4x 0,4x
– Sau pư: 0,07-0,4x 0
(0,07-0,4x)/(x+0,3) = 0,1 ⇒ x= 0,08 lít
* Ví dụ 2: Phải thêm bao nhiêu ml dung dịch HCl 1M vào 90 ml nước để được dung dịch có pH = 1?
* Hướng dẫn và đáp án:
– Ta có: pH = 1 ⇒ [H+] = 0,1M
– Đặt thể tích dung dịch HCl 1M cần thêm vào là V (lít)
⇒ nHCl = V mol
– Sau khi trộn với 90 ml H2O:
[H+] = CM(HCl sau trộn) = V/(V + 0,09) = 0,1M. ⇒ V = 0,01(l) = 10(ml).
* Ví dụ 3: Cho 100 ml dd hh gồm Ba(OH)2 0,1M và NaOH 0,1M với V ml dd hh gồm H2SO4 0,0375M và HCl 0,0125M thu được dd có pH = 2 . Giá trị V là:
* Hướng dẫn và đáp án:
– Ta có: nOH- = 0,03 mol; nH+ = 0,0875 V
– Dung dịch sau khi trộn pH = 2 → môi trường axit .
(0,0875V-0,03)/(0,1+V) = 10-2 ⇒ V = 0,4(l).
* Ví dụ 4: Trộn 300 ml dd hh gồm H2SO4 0,1M và HCl 0,15M với V ml dd hh gồm NaOH 0,3M và Ba(OH)2 0,1M, thu được dd X có pH = 12. Giá trị của V là:
* Hướng dẫn và đáp án:
– Ta có: nOH- = 0,5.V mol; nH+ = 0,0645 V
– Dung dịch sau khi trộn pH = 12 → môi trường bazo.
(0,5V – 0,0645)/(0,3+V) = 10-2 ⇒ V = 0,15(l).
Như vậy với các nội dung vận dụng Bài tập về sự điện li của nước, PH có hướng dẫn và đáp án ở trên, hy vọng các em đã hiểu rõ hơn và có thể ghi nhớ để giải các dạng bài tập sau này.
tmdl.edu.vn. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/bai-tap-ve-su-dien-li-cua-nuoc-ph-va-cach-giai-hoa-11-chuyen-de/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





