Công thức Lewis dùng để biểu diễn sự hình thành liên kết hoá học giữa các nguyên tử trong một phân tử. Công thức Lewis của một phần tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “–“.
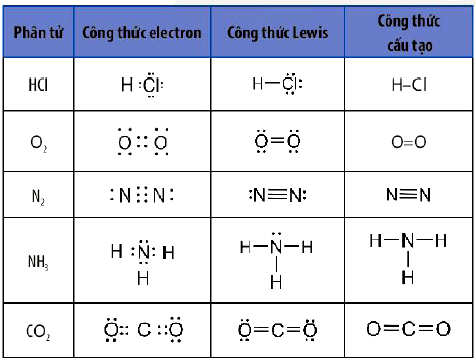
Ví dụ: Viết công thức Lewis của SO2, SO3, N2, NO2, HNO3, H2S, SF6, C2H2…
Bạn đang xem bài: Cách viết công thức Lewis đơn giản, dễ hiểu nhất
Viết Công thức Lewis của HCN
Bước 1: C có 4 electron hóa trị, H có 1 electron hóa trị, N có 5 electron hóa trị.
⇒ Tổng số electron hóa trị là: 4 + 1 + 5 = 10 electron.
Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử HCN
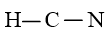
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 10 – 2 × 2 = 6 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 6 electron này để tạo octet cho N trước
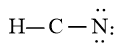
Bước 4: Đã sử dụng hết 6 electron để tạo octet cho N. Tuy nhiên C chưa đủ octet nên ta chuyển 2 cặp electron của nguyên tử N tạo thành cặp electron dùng chung giữa C và N. Nguyên tử H đã đủ octet
Vậy công thức Lewis của HCN là:
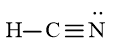
Viết Công thức Lewis của SO3
+ Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị là: 1.6 + 3.6 = 24 electron
+ Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử SO3
S có độ âm điện nhỏ hơn nên S là nguyên tử trung tâm.
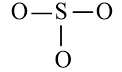
+ Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 24 – 2.3 = 18 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 18 electron này để tạo octet cho O trước (vì O có độ âm điện cao hơn)
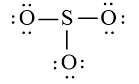
+ Bước 4: Đã sử dụng hết 18 electron để tạo octet cho O. Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
Công thức Lewis của SO3 là:
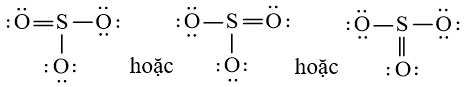
Viết Công thức Lewis của NH3
Bước 1. Tổng số electron hóa trị = 1.5 + 3.1 = 8 electron
Bước 2. Trong phân tử NH3, nguyên tử N cần 3 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh:
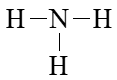
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.3 = 2
⇒ Chuyển 2 electron còn lại vào nguyên tử N để đạt octet, thu được công thức Lewis của phân tử NH3.
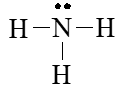
Viết Công thức Lewis của N2
+ Bước 1. Số electron hóa trị là 5.2 = 10 electron
+ Bước 2. Trong phân tử N2, mỗi nguyên tử N cần 3 electron để đạt octet.
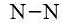
+ Bước 3. Mỗi nguyên tử N cần 6 electron hóa trị để đạt octet:
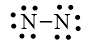
+ Bước 4. Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = – 4
– Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là:
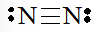
Viết Công thức Lewis của SO2
+ Bước 1. Số electron hóa trị là 1.6 + 2.6 = 18 electron.
+ Bước 2. Trong phân tử SO2, nguyên tử S cần 2 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, S là nguyên tử trung tâm, còn nguyên tử O được xếp xung quanh:
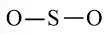
+ Bước 3. Hoàn thiện octet cho nguyên tử O:
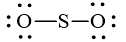
+ Bước 4. Số electron hóa trị còn lại: 18 – 2.2 – 2.6 = 2
Sử dụng 2 electron này để tạo octet cho S.
Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
Công thức Lewis của SO2 là:
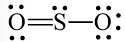
Viết Công thức Lewis của nitric acid HNO3
Bước 1: N có 5 electron hóa trị, O có 6 electron hóa trị, H có 1 electron hóa trị. Trong phân tử HNO3, có 1 nguyên tử H, 3 nguyên tử O và 1 nguyên tử N
⇒ Tổng số electron hóa trị N1 = 1.1 + 3.6 + 1.5 = 24 electron
Bước 2: Vẽ khung tạo bởi các nguyên tử liên kết với nhau:
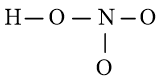
Số electron hóa trị đã dùng để xây dựng khung là N2 = 4.2 = 8 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 24 – 8 = 16 electron
Bước 3: Sử dụng N3 = 16 electron để tạo octet cho O trước
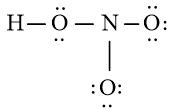
Bước 4: Đã sử dụng hết 16 electron để tạo octet cho O. Tuy nhiên N chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O bên phải tạo thành cặp electron dùng chung.
Chung cho hai nguyên tử O và N
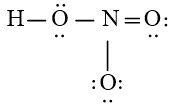
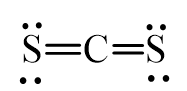
Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4
– Phân tử CS2: Mỗi nguyên tử S sẽ góp chung 2 electron mới nguyên tử C tạo thành 4 cặp electron dùng chung được biểu thị bằng 4 gạch nối.
– Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp chung 1 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung.
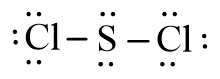
– Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron với nguyên tử C để tạo thành 4 cặp electron dùng chung.
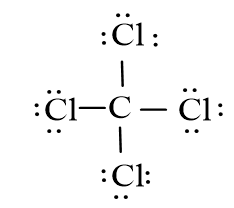
*****************
Trên đây là bài học về Công thức Lewis chi tiết, đầy đủ nhất. Hy vọng các em đã biết cách viết công thức Lewis của các phân tử. Chúc các em học tốt và đạt điểm cao trong các bài thi, bài kiểm tra nhé.
Đăng bởi: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá
Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/cach-viet-cong-thuc-lewis/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục