CÔNG THỨC HÓA HỌC LỚP 12 ĐẦY ĐỦ NHẤT




CHƯƠNG I. ESTE – LIPIT
A- MỘT SỐ VẤN ĐỀ LÍ THUYẾT CẦN NẮM VỮNG
1. Khái niệm về dẫn xuất của axit cacboxylic
– Dẫn xuất của axit cacboxylic là những sản phẩm tạo ra khi thay thế nhóm hiđroxyl –
OH trong nhóm cacboxyl -COOH bằng nguyên tử hay nhóm nguyên tử khác: -COOH -> –
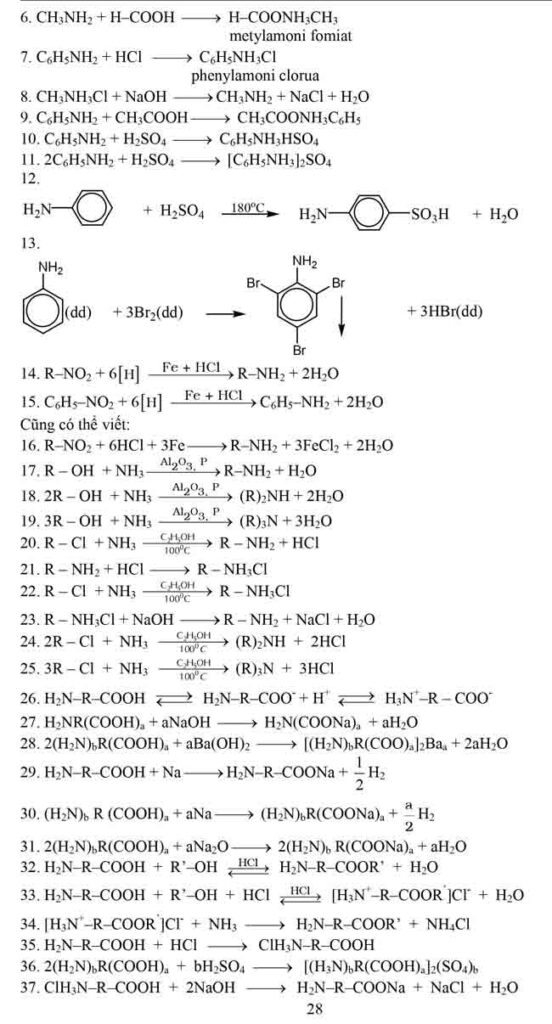
COZ (với Z: OR’, NH2, OCOR, halogen, …)
– Este là dẫn xuất của axit cacboxylic. Khi thay thế nhóm OH ở nhóm cacboxyl của axit
cacboxylic bằng nhóm OR’ thì được este.
– Halogenua axit (quan trọng nhất là clorua axit RCOCl). Để tạo ra halogenua axit có
thể dùng các tác nhân như PCl5 (photpho pentaclorua), PCl3 (photpho triclorua), COCl2
(photgen), SOCl2 (thionyl clorua), …
Bạn đang xem bài: Công thức Hóa Học lớp 12
(1) 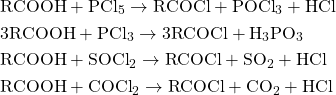
– Anhiđrit axit, có 2 loại: đối xứng (dạng (RCO)2O hoặc (ArCO)2O; gọi tên bằng cách thay từ axit bằng anhiđrit (CH3CO)2O là anhiđrit axetic), và không cân đối (sinh ra từ hai axit monocacboxylic khác nhau như CH3CO-O-OCC6H5; gọi tên bằng từ anhiđrit cộng với tên của hai axit – anhiđrit axetic benzoic)
Để tạo thành anhiđrit axit có thể sử dụng nhiều phương pháp khác nhau như dùng tác nhân hút nước P2O5 hay tác dụng của nhiệt, …
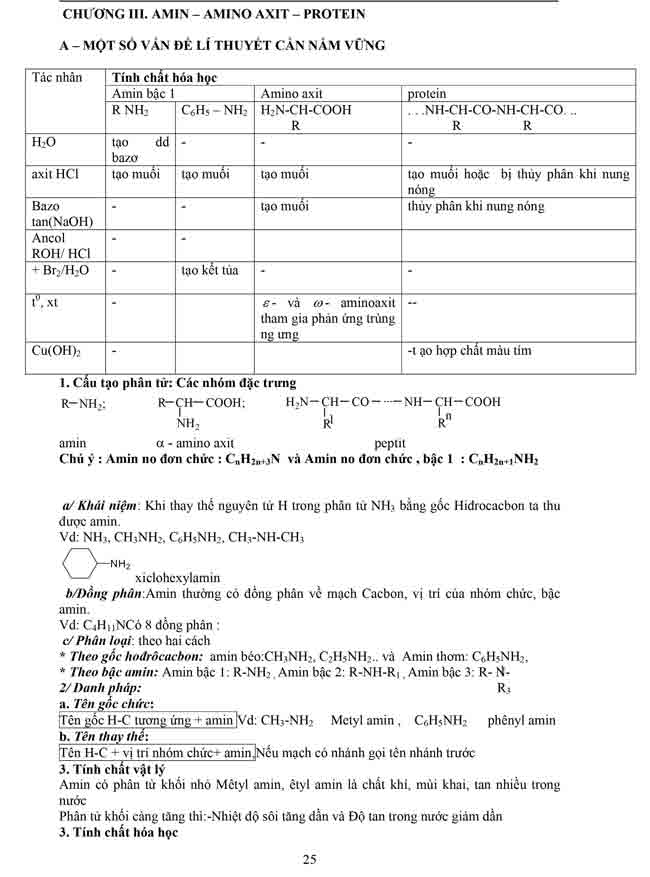
2. ESTE
2.1. Khái niệm : Khi thay nhóm OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm
OR thì được este
* Công thức tổng quát của este
a/ Trường hợp đơn giản: là este không chứa nhóm chức nào khác, ta có các công thức
như sau
-Tạo bởi axit cacboxylic đơn chức RCOOH và ancol đơn chức R’OH: RCOOR’.
– Tạo bởi axit cacboxylic đa chức R(COOH)a và ancol đơn chức R’OH: R(COOR’)a.
– Tạo bởi axit cacboxylic đơn chức RCOOH và ancol đa chức R'(OH)b: (RCOO)bR’.
– Tạo bởi axit cacboxylic đa chức R(COOH)a và ancol đa chức R'(OH)b: Rb(COO)abR’a.
Trong đó, R và R’ là gốc hiđrocacbon (no, không no hoặc thơm); trường hợp đặc biệt, R
có thể là H (đó là este của axit fomic H-COOH).
b/Trường hợp phức tạp: là trường hợp este còn chứa nhóm OH (hiđroxi este) hoặc este
còn chứa nhóm COOH (este – axit) hoặc các este vòng nội phân tử … Este trong trường
hợp này sẽ phải xét cụ thể mà không thể có CTTQ chung được. Ví dụ với glixerol và axit
axetic có thể có các hiđroxi este như HOC3H5(OOCCH3)2 hoặc (HO)2C3H5OOCCH3; hoặc
với axit oxalic và metanol có thể có este – axit là HOOC-COOCH3.
c/ Công thức tổng quát dạng phân tử của este không chứa nhóm chức khác
2.2.Lí tính :
– nhiệt độ sôi ,độ tan trong nước thấp hơn axit và ancol có cùng số cacbon :
axit > ancol > este
-Một số mùi đặc trưng : Isoamyl axetat : mùi chuối chín ; Etyl butiat ,etyl propionat có
mùi dứa
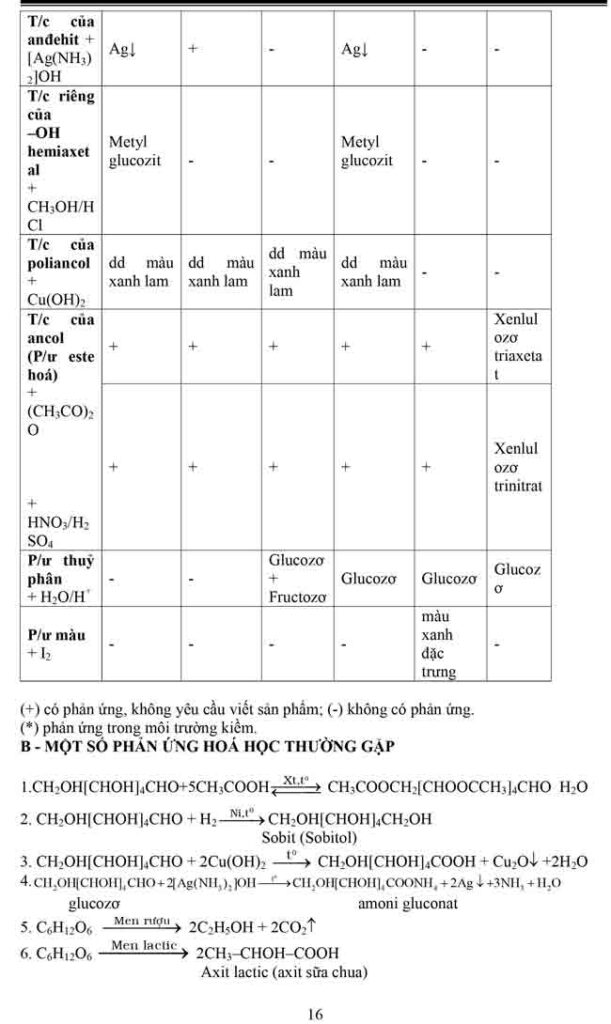
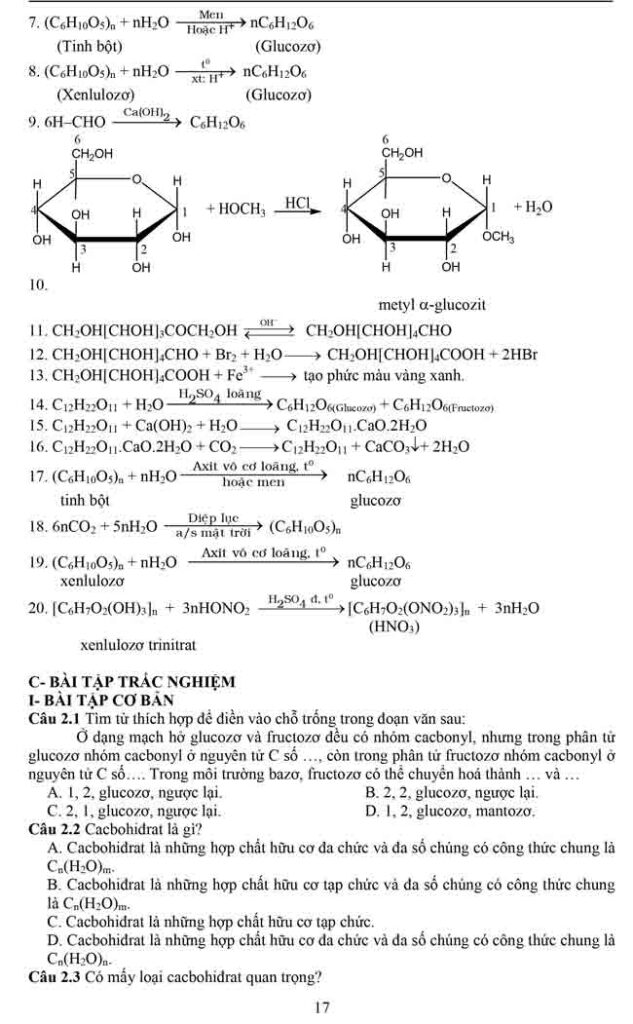
2.3 TÍNH CHẤT HÓA HỌC :
1. Phản ứng thủy phân
Tính chất hoá học quan trọng nhất của este là phản ứng thuỷ phân. Sơ đồ thuỷ phân
este (về cơ bản, chưa xét các trường hợp đặc biệt) là :
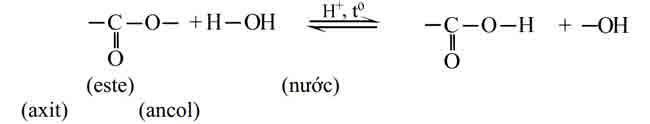
Thuỷ phân chính là quá trình nghịch của của phản ứng este hoá.
Phản ứng thuỷ phân có thể xảy ra trong môi trường axit hoặc môi trường bazơ.
– Phản ứng thuỷ phân trong môi trường kiềm được gọi là phản ứng xà phòng hoá.
Đặc điểm của phản ứng thuỷ phân este:
– Phản ứng thuỷ phân este trong môi trường axit là phản ứng thuận nghịch. Sản phẩm của phản ứng trong điều kiện này luôn có axit cacboxylic. Để chuyển dịch cân bằng về phía tạo axit và ancol, ta dùng lượng dư nước.
– Phản ứng thuỷ phân este không những thuận nghịch mà còn rất chậm. Để tăng tốc độ phản ứng thuỷ phân ta đun nóng hỗn hợp phản ứng với với chất xúc tác axit (H2SO4, HCl…).
– Phản ứng xà phòng hoá chỉ xảy ra một chiều, sản phẩm thu được luôn có muối của axit cacboxylic.
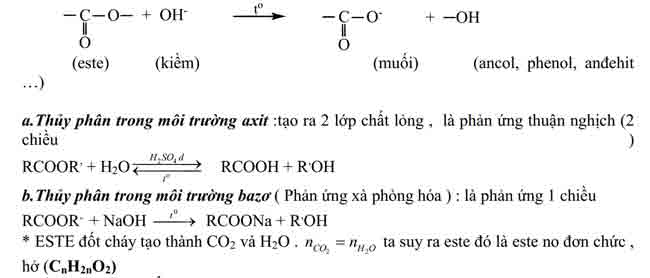
2/ Phản ứng của gốc hiđrocacbon
Este không no (este của axit không no hoặc ancol không no) có khả năng tham gia phản ứng cộng và phản ứng trùng hợp – đây là tính chất do liên kết – quy định (tương tự như hiđrocacbon tương ứng). Một số phản ứng thuộc loại này có ứng dụng quan trọng là :
– Phản ứng chuyển hoá dầu (chất béo lỏng) thành mỡ (chất béo rắn)
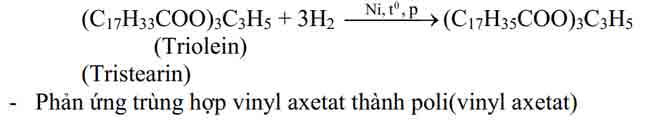

4. Một số phản ứng thuỷ phân đặc biệt của este
Căn cứ vào sơ đồ phản ứng xà phòng hoá hay phản ứng thuỷ phân este ta có thể căn cứ vào sản phẩm tạo thành để suy đoán cấu tạo của este ban đầu.
Không nhất thiết sản phẩm cuối cùng phải có ancol, tuỳ thuộc vào việc nhóm –OH đính vào gốc hiđrocacbon có cấu tạo như thế nào mà sẽ có các phản ứng tiếp theo xảy ra để có sản phẩm cuối cùng hoàn toàn khác nhau, hoặc nữa là do cấu tạo bất thường của este gây nên.
Một số trường hợp thuỷ phân đặc biệt của este (không chứa halogen) thường gặp trong bài toán định lượng là :
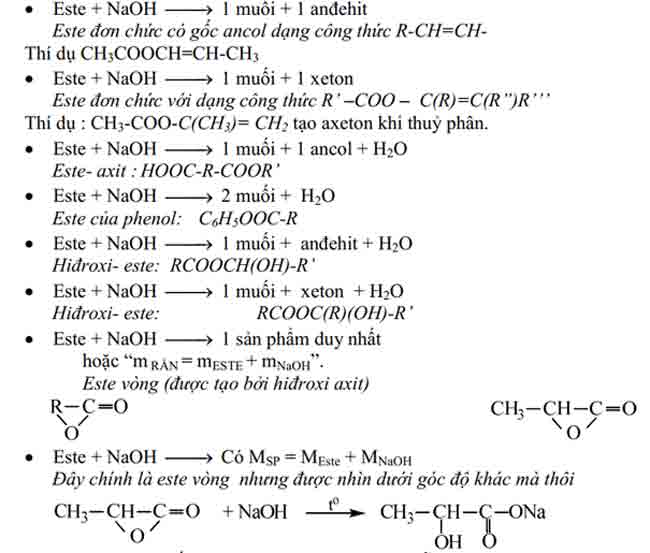
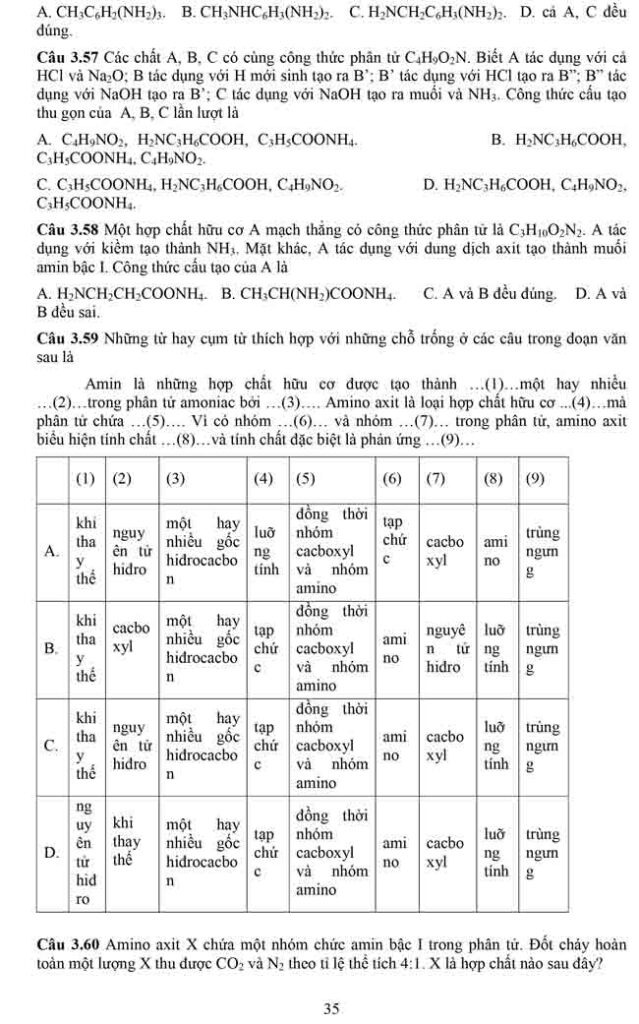
Chú ý các kết luận in nghiêng ngay dưới mỗi trường hợp trên đây chỉ là một thí dụ đơn giản nhất, các em chỉ được vận dụng khi không có dấu hiệu cho phép xác định cụ thể số nhóm chức este trước đó.
IV.ĐIỀU CHẾ.

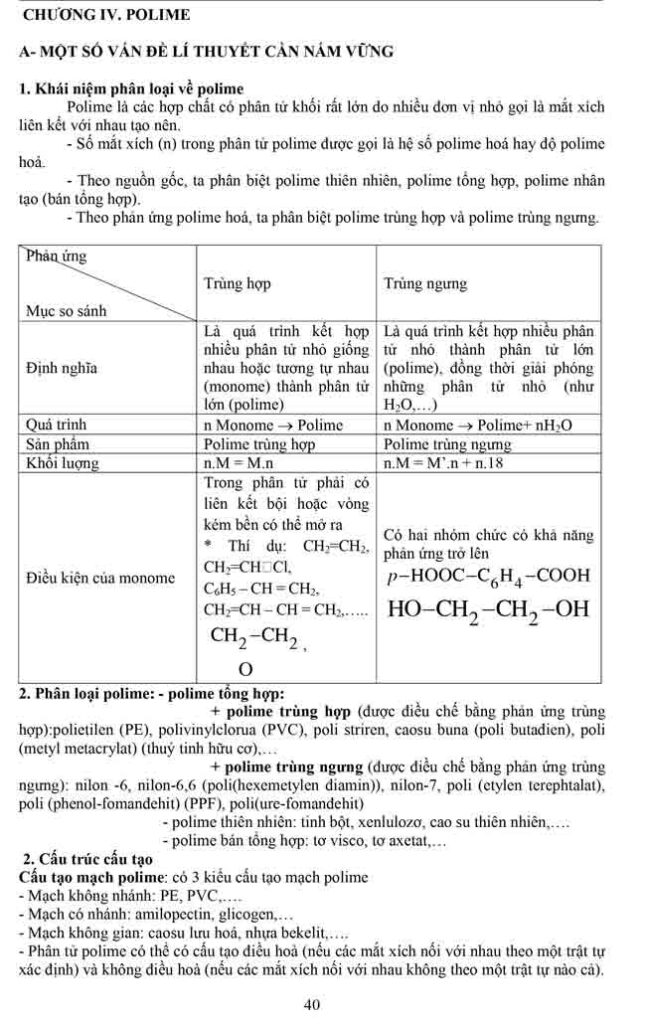
Bài 2. Lipit.
I. Khái niệm:Lipit là những hợp chất hữu cơ có trong tế bào sống,không hòa tan trong
nước nhưng tan nhiều trong dung môi hữu cơ không phân cực.
II. Chất béo:
1/ Khái niệm:
Chất béo là trieste của glixerol với axit béo gọi chung là triglixerit hay triaxylglixerol.
































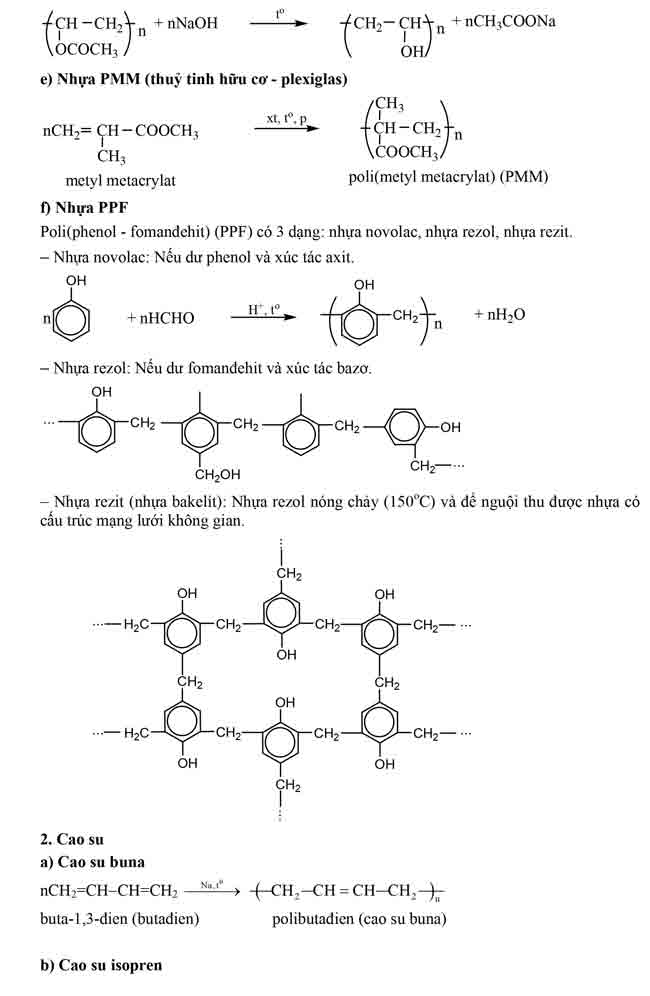






Tổng Hợp Lý Thuyết Hóa 12 : Tổng Hợp Các Dạng Giải Bài Tập Kim Loại
I. Tổng hợp lý thuyết hóa 12: Tổng hợp phương pháp
1. Phương pháp bảo toàn khối lượng:
Tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các sản phầm.
Ví dụ. trong phản ứng kim loại tác dụng với axit → muối + H2
Áp dụng bảo toàn khối lượng ta có:
mdung dịch muối = mkim loại + mdung dịch axit – mH2
2. Phương pháp tăng giảm khối lượng:
Dựa vào sự tăng giảm khối lượng khi chuyển từ 1 mol chất A thành 1 hoặc nhiều mol chất B (có thể qua nhiều giai đoạn trung gian) ta có thể tính được số mol của các chất và ngược lại.
Ví dụ. Xét phản ứng: Fe + CuSO4 → FeSO4 + Cu
Ta thấy: cứ 1 mol Fe (56 gam) tan ra thì có 1 mol Cu (64 gam) tạo thành, khối lượng thanh kim loại tăng 64 – 56 = 8 (gam). Như vậy nếu biết được khối lượng kim loại tăng thì có thể tính được số mol Fe phản ứng hoặc số mol CuSO4 phản ứng,…
3. Phương pháp sơ đồ dường chéo:
Thường áp dụng trong các bai tập hỗn hợp 2 chất khí, pha trộn 2 dung dịch, hỗn hợp 2 muối khi biết nồng độ phần trăm của dung dịch (C%) hoặc phân tử khối trung bình (M).
Ví dụ. tính tỉ lệ khối lượng của 2 dung dịch có nồng độ phần trăm tương ứng là C1, C2 cần lấy trộn vào nhau để được dung dịch có nồng độ C%.(C1 2)
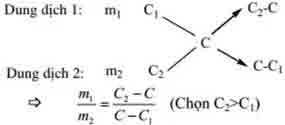
Đối với bài toán có hỗn hợp 2 chất khử, biết phân tử khối trung bình cũng nên áp dụng phương pháp sơ đồ chéo để tính số mol từng khí.
4. Phương pháp nguyên tử khối trung bình:
Trong các bài tập có hai hay nhiều chất có cùng thành phần hóa học, phản ứng tương tự nhau có thể thay chúng bằng một chất có công thức chung, như vậy việc tính toán sẽ rút gọn được số ẩn.
– Khối lượng phân tử trung bình của một hỗn hợp là khối lượng của 1 mol hỗn hợp đó.
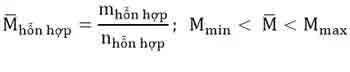
– Sau khi được giá trị , để tính khối lượng của mỗi chất trong hỗn hợp cũng áp dụng phương pháp sơ đồ chéo:
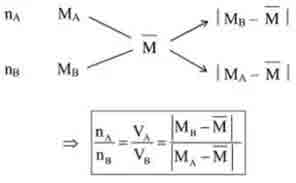
5. Phương pháp bảo toàn electron:
Phương pháp này áp dụng để giải các bài tập có nhiều quá trình oxi hóa khử xảy ra (nhiều phản ứng hoặc phản ứng tạo ra nhiều sản phẩm hoặc phản ứng qua nhiều giai đoạn). Chỉ cần viết các quá trình nhường, nhận electron của các nguyên tố trong các hợp chất. Lập phương trình tổng số mol electron nhường = tổng số mol electron nhận.
6. Phương pháp bảo toàn nguyên tố:
Trong các phản ứng hóa học số mol nguyên tử của các nguyên tố được bảo toàn trước và sau phản ứng.
Ví dụ. xét phản ứng CO + oxit kim loại → kim loại + CO2
Bào toàn nguyên tử O: nCO = nCO2 = nO trong các oxit
7. Phương pháp viết pt phản ứng dưới dạng rút gọn:
Khi giải các bài toán có phản ứng của dung dịch hỗn hợp nhiều chất (dung dịch gồm 2 axit, 2 bazo,…) để tránh viết nhiều phương trình phản ứng, đơn giản tính toán ta viết phương trình ion rút gọn.
II. Tổng hợp lý thuyết hóa học 12: Tổng hợp ví dụ vận dụng phương pháp
Bài 1: Hòa tan 1,35 gam một kim loại M bằng dung dịch HNO3 loãng dư thu được 2,24 lít hỗn hợp khí NO và NO2 (đktc) có tỉ khối hơi so với hidro bằng 21. Tìm M.
Hướng dẫn:
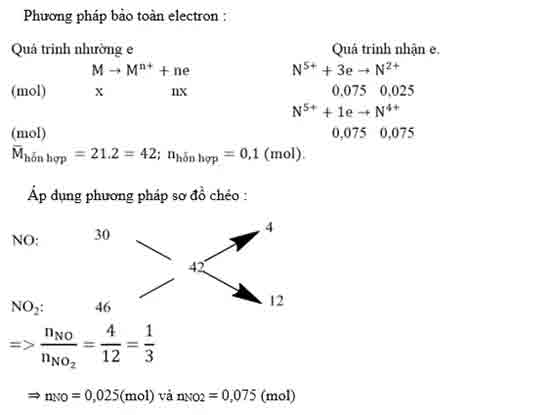

Bài 2: Hòa tan 4,59 gam nhôm trong dung dịch HNO3 1M thu được hỗn hợp X gồm hai khí NO và NO2, tỉ khối hơi của X đối với hidro bằng 16,75. Tính :
a) Thể tích mỗi khí đo ở đktc.
b) Khối lượng muối thu đươc.
c) Thể tích dung dịch HNO3 đã dùng.
Hướng dẫn:


III. Tổng hợp lý thuyết hóa học 12: tổng hợp bài tập trắc nghiệm
Bài 1: Một dung dịch có chứa các ion: x mol M3+, 0,2 mol Mg2+, 0,3 mol Cu2+, 0,6 mol SO42-, 0,4 mol NO3–. Cô cạn dung dịch này thu được 116,8 gam hỗn hợp các muối khan. M là:A. Cr B. Fe. C. Al D. Zn
Đáp án: A
Áp dụng định luật bảo toàn điện tích, ta có:
3x + 0,2.2 + 0,3.2 = 0,6.2 + 0,4 ⇒ x = 0,2 mol
Ta có: mmuối = mM3+ + mMg2+ + mCu2+ + mSO42- + mNO3–
116,8 = 0,2.MM + 0,2.44 + 0,3.64 + 0,6.96 + 0,4.62
MM = 52 ⇒ M là Cr.
Bài 2: Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.A. 1M B. 0,5M C. 0,25M D. 0,4M
Đáp án: B
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình: Fe + CuSO4 → Cu + FeSO4
Cứ 1 mol Fe (56 gam) tác dụng với 1 mol CuSO4 → 1 mol Cu (64 gam).
Khối lượng đinh sắt tăng: 64 – 56 = 8 (gam)
Thực tế khối lượng đinh sắt tăng 0,8 (gam)
Vậy nCuSO4 phản ứng = 0,8/8 = 0,1(mol) và CMCuSO4 = 0,1/0,2 = 0,5M
Bài 3: Hỗn hợp bột gồm 3 kim loại Mg, Al, Zn có khối lượng 7,18 gam được chia làm hai phần đều nhau. Phần 1 đem đốt cháy hoàn toàn trong oxi dư thu được 8,71 gam hỗn hợp oxit. Phần 2 hòa tan hoàn toàn trong HNO3 đặc nóng dư thu được V lít (đktc) khí NO2 (sản phẩm khử duy nhất). Hãy tính giá trị của V.A. 14,336l B. 11,2l C. 20,16l C. 14,72l
Đáp án: A

Link tải:
CÔNG THỨC HÓA HỌC LỚP 12
MỘT SỐ CÔNG THỨC KINH NGHIỆM DÙNG GIẢI NHANH BÀI TOÁN HÓA HỌC
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/cong-thuc-hoa-hoc-lop-12/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





