Công thức tính số mol, bài tập mol
Công thức tính số mol là nền tảng cho mọi bài toán hóa học. Bất kì bài toán nào đều sử dụng đến nó, vì vậy khi bắt đầu làm quen với môn hóa học, việc chúng ta phải làm là học thuộc và biết cách sử dụng nó.
Bạn đang xem bài: Công thức tính số mol, bài tập mol
Nội dung chính
Số mol là gì?
Mol là một đơn vị đo lường theo hệ SI, diễn tả lượng chất có chứa 6,022.1023 số hạt nguyên tử hoặc phân tử.
Ví dụ: 1 mol Al = 6,022.1023 nguyên tử Al
Các công thức tính số mol
Tính số mol qua khối lượng
– Khi biết được khối lượng của một chất hoặc hợp chất, ta tính số mol như sau:
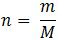
Trong đó:
+ n : số mol chất (mol)
+ m: khối lượng chất (g)
+ M: Khối lượng mol chất (g/mol)
Tính số mol qua thể tích
– Ở điều kiện tiêu chuẩn, nếu biết thể tích của một chất, ta có số mol của chất đó được tính như sau:
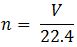
Trong đó:
+ n: số mol chất khí ở đktc (mol)
+ V: thể tích khí (lit)
– Ở điều kiện thường, số mol của một chất được tính thông qua một số đại lượng như sau:
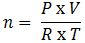
Trong đó:
+ n: số mol khí ở điều kiện thường (mol)
+ P: Áp suất (atm)
+ V: thể tích khí (lit)
+ R: hằng số = 0.082
+ T: nhiệt độ = 273 + t (K)
Tính số mol qua số Avogadro
Khi có số nguyên tử hoặc phân tử của một chất hoặc hợp chất, ta có:
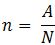
Trong đó:
+ A: số nguyên tử hoặc phân tử
+ N: số Avogadro = 6,022.10-23
+ n: số mol (mol)
Tính số mol qua nồng độ
Nồng độ mol
Khi biết được nồng độ mol và thể tích của một dung dịch, ta có công thức:
Trong đó:
+ n: số mol (mol)
+ C: Nồng độ mol của dung dịch (M)
+ V: thể tích của dung dịch (lit)
Nồng độ phần trăm
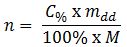
Trong đó:
+ n: số mol (mol)
+ C: nồng độ % của dung dịch (%)
+ m: khối lượng của dd sau phản ứng (g)
+ M: khối lượng mol (g/mol)
– Khi biết đề không cho khối lượng m mà cho thể tích V và khối lượng riêng D ta tính như sau:
Trong đó
+ n: số mol (mol)
+ C: nồng độ % của dung dịch (%)
+ V: thể tích của dung dịch (ml)
+ D: khối lượng riêng (g/ml)
+ M: khối lượng mol (g/mol)
Thực chất công thức trên là ta thay m = D x V vào tử số
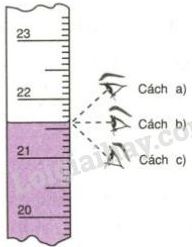
Cách tính số mol dư
– Khi đề bài yêu cầu: Xác định sau phản ứng, chất nào còn dư? Lúc này chúng ta sẽ tính số mol dư theo công thức sau: Số mol (dư) = Tổng số mol ban đầu – tổng số mol đã phản ứng
Lưu ý:
– Tổng số mol đã phản ứng được tính theo những chất đã phản ứng hết
– Sau khi cân bằng phương trình, ta lấy số mol ban đầu của đề bài chia cho hệ số cân bằng tương ứng, số nào lớn hơn thì đó là chất dư, chất còn lại là chất đã phản ứng hết.

Bài tập mol
Trắc nghiệm
Câu 1: Đốt cháy hết 9g kim loại Mg trong không khí thu khối lượng 15g hợp chất`magie oxit .Biết rằng magie cháy là xảy ra phản ứng khí oxi (O2)trong không khí. Tính số g khối lượng khí oxi phản ứng:
A. 3g B. 4g C. 5 g D . 6g
Câu 2: Nung 2,45 gam Kaliclorat. Sau khi phản ứng xảy ra hoàn toàn thì thể tích khí oxi thu được (ở đktc) là bao nhiêu?
A 0,448 lít B 0,672 lít C 0,336 lít D 0,56 lít
Câu 3: Oxi hóa 2,24 gam sắt bằng 0,448 lít khí oxi (ở đktc) thu được oxit sắt từ Fe3O4. Khối lượng oxit sắt từ thu được là:
A 4,64 gam B 11,6 gam C 23,2 gam D 2,32 gam
Câu 4: Đốt cháy hoàn toàn bột nhôm trong khí oxi lấy dư. Sau khi phản ứng xảy ra hoàn toàn thu được 2,04 gam nhôm oxit. Tính thể tích khí oxi cần dùng cho phản ứng (ở đktc)
A 0,448 lít B 0,672 lít C 0,336 lít D 0,56 lít
Câu 5: Đốt cháy hoàn toàn Magie trong khí oxi lấy dư. Sau khi phản ứng xảy ra hoàn toàn thu được 1 gam magie oxit. Tính thể tích khí oxi cần dùng cho phản ứng (ở đktc)
A 0,224 lít B 0,672 lít C 0,28 lít D 0,336 lít
Tự luận
Bài 1: Viết công thức hóa học và tính phân tử khối của Bạc nitrat, biết bạc nitrat có phân tử gồm 1 Ag, 1 N và 3 O. Bạc nitrat là đơn chất hay hợp chất?
Bài 2: Tính khối lượng bằng gam của nguyên tử sắt?
Bài 3: Một hợp chất có phân tử gồm 2 nguyên tử M liên kết với 1 nguyên tử Oxi và cho biết hợp chất này nặng hơn phân tử Hiđro 116 lần. Hãy cho biết:
a) Phân tử khối của hợp chất?
b) Nguyên tử khối của M? Tên và kí hiệu của nguyên tố M?
Bài 4: Em hãy tìm khối lượng của:
a) 1 mol nguyên tử Cl và 1 mol phân tử Cl2
b) 1 mol nguyên tử Cu và 1 mol phân tử CuO
c) 1 mol nguyên tử C, 1 mol phân tử CO, 1 mol phân tử CO2
d) 1 mol phân tử NaCl, 1 mol phân tử C12H22O11 (đường)
Bài 5: Em hãy tìm thể tích (ở đktc) của:
a) 1 mol phân tử CO2; 2 mol phân tử H2; 1,5 mol phân tử O2;
b) 0,25 mol phân tử O2 và 1,25 mol phân tử N2.
Công thức tính số mol bao gồm khá nhiều công thức, tuy nhiên chúng không khó để nhớ. Cách ghi nhớ lâu và nhanh nhất đó là làm bài tập. Sau khi nhớ và biết cách áp dụng thì việc tính số mol là rất đơn giản nhưng nó lại rất quan trọng vì hầu hết tất cả các bài toán đều sử dụng đến nó.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/cong-thuc-tinh-so-mol-bai-tap-mol/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




