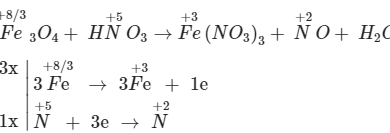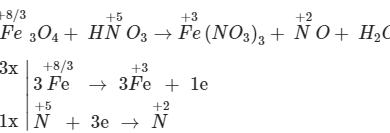Các nguyên tố kim loại được sắp xếp theo một thứ tự có quy luật theo thứ tự các kim loại có tính oxi hóa và tính khử, cách sắp xếp này gọi là dãy điện hóa kim loại. Vậy khái niệm dãy điện hóa kim loại là gì? Những đặc điểm và ý nghĩa sẽ được giải thích chi tiết trong bài viết này.
Định nghĩa dãy điện hóa của kim loại là gì?
Dãy điện hóa kim loại hay còn gọi là dãy hoạt động hóa học của kim loại là danh sách các kim loại được liệt kê theo thứ tự giảm dần khả năng phản ứng hoặc theo thứ tự giảm dần tính dễ oxi hóa.
Bạn đang xem bài: Dãy điện hóa của kim loại là gì?
Các kim loại ở đầu dãy điện hóa như kim loại kiềm và kim loại kiềm thổ, phản ứng mạnh hơn hoặc dễ bị oxi hóa hơn các kim loại ở cuối dãy như kim loại vàng, bạc.
Về cơ bản, điều này có nghĩa là chúng có thể phản ứng dễ dàng hơn để tạo thành các hợp chất. Những kim loại ở đầu dãy hoạt động được gọi là kim loại hoạt động mạnh và kim loại ở cuối dãy gọi là kim loại hoạt động yếu.
Danh sách dãy điện hóa kim loại
Người ta đã so sánh tính chất của nhiều cặp oxi hóa khử và sắp xếp thành dãy điện hóa của kim loại theo thứ tự sau:
Bảng dãy điện hóa kim loại dựa theo tính oxi hóa tăng dần
K+ -> Na+ -> Mg2+ -> Al3+ -> Zn2+ -> Fe2+ -> Ni2+ -> Sb2+ -> Pb2+ -> H+ -> Cu2+ -> Ag+ -> Au3+
Có nghĩa là nguyên tố Kali (K+) là kim loại có tính oxi hóa thấp nhất và nguyên tố Vàng (Au3+) là kim loại có tính oxi hóa mạnh nhất.
Bảng dãy điện hóa kim loại sắp xếp theo tính khử giảm dần
K -> Na -> Mg -> Al -> Zn -> Fe -> Ni -> Sn -> Pb -> H2 -> Cu -> Ag -> Au
Kim loại nào có tính khử càng mạnh thì là kim loại hoạt động mạnh và ngược lại kim loại có tính oxi hóa càng mạnh thì là kim loại hoạt động yếu.
Kim loại Kali (K) là kim loại hoạt động mạnh nhất và kim loại Vàng (Au) là kim loại hoạt động yếu nhất.
Thường thì chúng ta sẽ dựa vào vị trí của nguyên tố Hidro(H2) để so sánh kim loại hoạt động mạnh hay yếu. Nếu Kim loại nào đứng trước nguyên tố H2 thường là các kim loại hoạt động mạnh. Kim loại đứng sau nguyên tố H2 là kim loại hoạt động yếu.
Kim loại đứng trước kim loại đứng sau trong dãy điện hóa có thể khử kim loại đứng sau đó thành kim loại tự do.
Một vài đặc điểm về dãy điện hóa kim loại
- Mức độ hoạt động hóa học của kim loại giảm dần từ trái qua phải.
- Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành dung dịch kiềm và giải phóng khí Hiđro. Ví dụ: 2K + 2H2O → 2KOH + H2
- Kim loại đứng trước H2 phản ứng với một số dung dịch axit mạnh như HCl, H2SO4, HNO3 loãng và giải phóng khí H2. Ví dụ: Mg + 2HCl → MgCl2 + H2
- Kim loại đứng trước trừ các kim loại kiềm đẩy kim loại đứng sau ra khỏi dung dịch muối. Ví dụ Fe + CuSO4 → FeSO4 + Cu
Ý nghĩa của dãy điện hóa kim loại là gì?
Dãy điện hóa kim loại cho phép dự đoán chiều của phản ứng giữa 2 cặp oxi hóa – khử theo quy tắc α. Phản ứng giữa 2 cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn và sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
Ví dụ: Phản ứng giữa 2 cặp Fe2+/Fe và Cu2+/Cu xảy ra theo chiều ion Cu2+ oxi hóa Fe tạo ra ion Fe2+ và Cu.
Lưu ý: Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại.
Ứng dụng của dãy điện hóa kim loại
Cùng theo dõi bài viết để biết thêm về ứng dụng của dãy điện hóa các bạn nhé.
Xác định được khả năng phản ứng của kim loại
- Hoạt động của kim loại phụ thuộc vào xu hướng mất điện tử hay xu hướng tạo electron, tức là xu hướng tạo thành cation. Xu hướng này phụ thuộc vào tính khử của kim loại đó.
- Kim loại có giá trị âm cao hoặc giá trị dương nhỏ hơn dễ bị mất điện tử hoặc electron và được chuyển thành cation. Một kim loại như vậy là kim loại hoạt động mạnh.
- Khả năng phản ứng hoá học của các kim loại giảm dần từ trên xuống dưới trong dãy. Kim loại đứng đầu trong dãy điện hóa hoạt động hơn kim loại đứng sau dãy điện hóa.
Ví dụ 1: Kim loại kiềm và kim loại kiềm thổ có tính khử cao vì vậy đây là những kim loại hoạt động mạnh nhất. Chúng phản ứng với nước và tạo ra hydro. Những chất này dễ dàng hòa tan trong axit tạo thành muối tương ứng và kết hợp với những chất nhận electron.
Ví dụ 2: Các kim loại như Fe, Pb, Sn, Ni, Co, … nằm trong dãy đồng đẳng không phản ứng với nước ở nhiệt độ thường nhưng phản ứng với hơi nước ( nước ở nhiệt độ cao) để tạo ra hidro.
Ví dụ 3: Các kim loại như Cu, Ag và Au nằm sau hiđro thì phản ứng kém hơn và không tác dụng với nước được.
Xác định được tính điện dương của kim loại
Tính chất điện dương còn phụ thuộc vào khuynh hướng mất điện tử của kim loại đó. Giống như khả năng phản ứng, tính chất điện động của kim loại giảm dần từ trên xuống dưới trong dãy điện hóa. Trên cơ sở giá trị khử của kim loại, chúng ta có thể chia thành 3 nhóm gồm:
- Kim loại nhiễm điện mạnh: Kim loại có tính khử tiêu chuẩn gần âm hơn hoặc bằng khoảng 2,0 vôn như kim loại kiềm, kim loại kiềm thổ có bản chất là điện dương mạnh.
- Kim loại có tính điện động trung bình: Các kim loại có giá trị thế khử trong khoảng từ 0,0 đến 2,0 vôn là các kim loại như Al, Zn, Fe, Ni, Co…
- Điện dương yếu: Kim loại nào dưới hiđro và có giá trị dương của thế khử là kim loại có tính điện động yếu như Cu, Hg, Ag…
Tính oxi hóa của phi kim loại
Bản chất oxi hóa phụ thuộc vào khuynh hướng nhận electron hoặc cho electron. Giá trị của thế khử càng cao, xu hướng nhận electron càng cao. Như vậy, tính chất oxi hóa tăng dần từ trên xuống trong dãy điện hóa. Độ mạnh của chất oxi hóa tăng khi giá trị của thế khử ngày càng dương.
Tính bền nhiệt của oxit kim loại
Độ bền nhiệt của oxit kim loại phụ thuộc vào bản chất điện dương của nó. Khi độ nhạy điện giảm dần từ trên xuống, độ bền nhiệt của oxit cũng giảm dần từ trên xuống dưới. Oxit của kim loại có thế khử dương cao không bền với nhiệt. Các kim loại đứng sau kim loại đồng tạo thành các oxit không ổn định, tức là chúng bị phân hủy khi đun nóng.
Trên đây là đáp án dãy điện hóa của kim loại là gì? chi tiết và đầy đủ nhất. Hy vọng bạn sẽ hiểu được những ý nghĩa quan trọng của dãy điện hóa kim loại từ đó phục vụ tốt cho việc học. Cảm ơn bạn đã theo dõi bài viết.
Trang chủ: tmdl.edu.vn
Danh mục bài: Công thức Hóa Học