Độ điện li là gì? Hằng số phân li là gì? phụ thuộc vào yếu tố nào?. Ở các bài trước các em đã biết có chất điện li mạnh và có chất điện li rất yếu và để đánh giá được mức độ điện li ra ion của chất điện li trong dung dịch người ta dùng khái niệm độ điện li.
Vậy độ điện li là gì? hằng số phân li là gì các tính ra sao? hằng số phân li thuộc vào yếu tố nào?chúng ta sẽ biết qua bài viết dưới đây.
Bạn đang xem bài: Độ điện li là gì? Hằng số phân li là gì? phụ thuộc vào yếu tố nào?
I. Độ điện li
– Độ điện li α (anpha) của chất điện li là tỉ số giữa số phân tủ phân li ra ion (n) và tổng số phân tử hòa tan (n0).
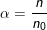
* Ví dụ: Độ điện li của CH3COOH trong dung dịch nồng độ 0,043M là 0,02 hay 2%, nghĩa là: Trong dung dịch này cứ 100 phân tử CH3COOH hòa tan có 2 (=n) phân tử phân tử phân li ra ion, còn lại 98 (=n0) phân tử không phân li ra ion, vậy:
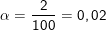
Như vậy, theo định nghĩa về độ điện li thì chất điện li mạnh có α = 1, chất điện li yêu có 0 < α < 1. Chất có α = 0 là chất không điện li.
– Khi pha loãng dung dịch thì độ điện li của các chất điện li đều tăng.
* Ví dụ: Ở 250C, độ điện li của CH3COOH trong dung dịch nồng độ 0,1M là 1,3%, trong dung dịch 0,01M là 4,1%.
II. Hằng số phân li
– Sự phân li của chất điện li yếu trong dung dịch là quá trình thuận nghịch.
– Khi tốc độ phân li (chiều thuận) và tốc độ kết hợp các ion tạo lại phân tử (chiều nghịch) bằng nhau → cân bằng của quá trình điện li được kết lập.
– Giống như mọi cân bằng hóa học khác, cân bằng điện li cũng có hằng số cân bằng.
* Ví dụ: CH3COOH là axit yếu, trong dung dịch có cân bằng sau:
CH3COOH  CH3COO– + H+
CH3COO– + H+
– Ở trạng thái cân bằng nồng độ CH3COOH và nồng độ của các ion CH3COO–, H+ không biến đổi, nên ta có:
![small frac{[CH_3COO^-].[H^+]}{[CH_3COOH]}=K_a 1631717725p596hbghf9 1631738945 1631787241 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1631717725p596hbghf9_1631738945_1631787241-1.gif)
Ở đây, [CH3COOH], [CH3COO–], [H+], là nồng độ mol của CH3COOH, CH3COO–, H+ ở trạng thái cân bằng.
– Hằng số cân bằng K ở đây chính là hằng số phân li.
– Giá trị của hằng số phân li Ka chỉ phụ thuộc vào bản chất axit và nhiệt độ.
– Giá trị của hằng số phân li Ka của axit càng nhỏ, lực axit của nó càng yếu.
* Ví dụ: Ở 250C, Ka của CH3COOH là 1,75.10-5 và của HClO là 5,9.10-8.
→ Lực axit của HClO yếu hơn so với lực axit của CH3COOH, nghĩa là nếu hai axit này có cùng nồng độ mol ở cùng nhiệt độ thì nồng độ mol H+ trong dung dịch HClO nhỏ hơn.
– Bazơ yếu cũng có hằng số phân li bazơ Kb
– Giá trị hằng số phân li bazơ Kb cũng chỉ phụ thuộc vào bản chất bazơ và nhiệt độ.
⇒ Độ điện li phụ thuộc vào: Nhiệt độ, Bản chất của chất điện li (thể hiện qua hằng số điện li, phân li K) và nồng độ của chất điện li.
III. Vận dụng biết hằng số điện li tính pH của axit, bazơ
* Bài tập 1: Tính pH của dung dịch CH3COOH 0,1M biết hằng số điện li của nó là pKa = 4,75.
(Lưu ý: pKa = -lgKa và pKb = -lgKb)
* Lời giải:
– Ta có, phương trình phân li (t0 thời điển ban đầu, tcb thời điểm khi PT đijện li đạt trạng thái cân bằng):
CH3COOH 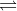 CH3COO– + H+
CH3COO– + H+
t0: 0,1 0 0
pli: x x x
tcb: 0,1 – x x x
Mà pKa = -lgKa = 4,75 ⇒ Ka = 10-4,75
Từ biểu thức tính Ka ta có:
![small K_a=frac{[CH_3CO^-][H^+]}{[CH_3COOH]} Leftrightarrow 10^{-4,75}=frac{x.x}{0,1-x} 1631738947w8ygnyfafe 1631787242](https://tmdl.edu.vn/wp-content/uploads/2023/03/1631738947w8ygnyfafe_1631787242.gif)
⇒ x2 = 10-4,75.0,1 – 10-4,75.x
⇒ x = 1,325.10-3 (nhận) hoặc x = -1,34.10-3(loại).
Vậy pH = -lg(1,325.10-3) = 2,87.
* Bài tập 2: Tính pH của dung dịch NH4OH 1M biết hằng số điện li của nó là Kb = 1,75.10-5.
* Lời giải:
– Ta có, phương trình phân li (t0 thời điển ban đầu, tcb thời điểm khi PT đijện li đạt trạng thái cân bằng):
NH4OH 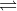 NH4+ + OH–
NH4+ + OH–
t0: 1 0 0
pli: x x x
tcb: 1 – x x x
Từ biểu thức tính Kb ta có:
![small K_b=frac{[NH_{4}^{+}][OH^-]}{[NH_4OH]} Leftrightarrow 1,76.10^{-5}=frac{x.x}{1-x} 16317389513pwaqut9as 1631787242](https://tmdl.edu.vn/wp-content/uploads/2023/03/16317389513pwaqut9as_1631787242.gif)
⇒ x2 = 1,76.10-5 – 1,76.10-5x
⇒ x = 4,1864.10-3 (nhận)
hoặc x = 4,2.10-3 (loại)
Vậy pOH = -lg(4,1864.10-3) = 2,378
⇒ pH = 14 – 2,378 = 11,62.
(lưu ý: pOH + pH = 14).
Như vậy với bài viết này các em đã có thể hiểu được Độ điện li là gì? Hằng số phân li là gì? phụ thuộc vào yếu tố nào? Chúc các em học tốt, mọi góp ý và thắc mắc các em hãy để lại nhận xét ở dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoághi nhận và hỗ trợ nhé.
Xem thêm về Độ điện li là gì?
Độ điện li là gì? Hằng số phân li là gì? phụ thuộc vào yếu tố nào?. Ở các bài trước các em đã biết có chất điện li mạnh và có chất điện li rất yếu và để đánh giá được mức độ điện li ra ion của chất điện li trong dung dịch người ta dùng khái niệm độ điện li. Vậy độ điện li là gì? hằng số phân li là gì các tính ra sao? hằng số phân li thuộc vào yếu tố nào?chúng ta sẽ biết qua bài viết dưới đây. I. Độ điện li – Độ điện li α (anpha) của chất điện li là tỉ số giữa số phân tủ phân li ra ion (n) và tổng số phân tử hòa tan (n0). small alpha =frac{n}{n_0} * Ví dụ: Độ điện li của CH3COOH trong dung dịch nồng độ 0,043M là 0,02 hay 2%, nghĩa là: Trong dung dịch này cứ 100 phân tử CH3COOH hòa tan có 2 (=n) phân tử phân tử phân li ra ion, còn lại 98 (=n0) phân tử không phân li ra ion, vậy: small alpha =frac{2}{100}=0,02 Như vậy, theo định nghĩa về độ điện li thì chất điện li mạnh có α = 1, chất điện li yêu có 0 < α < 1. Chất có α = 0 là chất không điện li. – Khi pha loãng dung dịch thì độ điện li của các chất điện li đều tăng. * Ví dụ: Ở 250C, độ điện li của CH3COOH trong dung dịch nồng độ 0,1M là 1,3%, trong dung dịch 0,01M là 4,1%. II. Hằng số phân li – Sự phân li của chất điện li yếu trong dung dịch là quá trình thuận nghịch. – Khi tốc độ phân li (chiều thuận) và tốc độ kết hợp các ion tạo lại phân tử (chiều nghịch) bằng nhau → cân bằng của quá trình điện li được kết lập. – Giống như mọi cân bằng hóa học khác, cân bằng điện li cũng có hằng số cân bằng. * Ví dụ: CH3COOH là axit yếu, trong dung dịch có cân bằng sau: CH3COOH rightleftharpoons CH3COO- + H+ – Ở trạng thái cân bằng nồng độ CH3COOH và nồng độ của các ion CH3COO-, H+ không biến đổi, nên ta có: small frac{[CH_3COO^-].[H^+]}{[CH_3COOH]}=K_a Ở đây, [CH3COOH], [CH3COO-], [H+], là nồng độ mol của CH3COOH, CH3COO-, H+ ở trạng thái cân bằng. – Hằng số cân bằng K ở đây chính là hằng số phân li. – Giá trị của hằng số phân li Ka chỉ phụ thuộc vào bản chất axit và nhiệt độ. – Giá trị của hằng số phân li Ka của axit càng nhỏ, lực axit của nó càng yếu. * Ví dụ: Ở 250C, Ka của CH3COOH là 1,75.10-5 và của HClO là 5,9.10-8. → Lực axit của HClO yếu hơn so với lực axit của CH3COOH, nghĩa là nếu hai axit này có cùng nồng độ mol ở cùng nhiệt độ thì nồng độ mol H+ trong dung dịch HClO nhỏ hơn. – Bazơ yếu cũng có hằng số phân li bazơ Kb – Giá trị hằng số phân li bazơ Kb cũng chỉ phụ thuộc vào bản chất bazơ và nhiệt độ. ⇒ Độ điện li phụ thuộc vào: Nhiệt độ, Bản chất của chất điện li (thể hiện qua hằng số điện li, phân li K) và nồng độ của chất điện li. III. Vận dụng biết hằng số điện li tính pH của axit, bazơ * Bài tập 1: Tính pH của dung dịch CH3COOH 0,1M biết hằng số điện li của nó là pKa = 4,75. (Lưu ý: pKa = -lgKa và pKb = -lgKb) * Lời giải: – Ta có, phương trình phân li (t0 thời điển ban đầu, tcb thời điểm khi PT đijện li đạt trạng thái cân bằng): CH3COOH rightleftharpoons CH3COO- + H+ t0: 0,1 0 0 pli: x x x tcb: 0,1 – x x x Mà pKa = -lgKa = 4,75 ⇒ Ka = 10-4,75 Từ biểu thức tính Ka ta có: small K_a=frac{[CH_3CO^-][H^+]}{[CH_3COOH]} Leftrightarrow 10^{-4,75}=frac{x.x}{0,1-x} ⇒ x2 = 10-4,75.0,1 – 10-4,75.x ⇒ x = 1,325.10-3 (nhận) hoặc x = -1,34.10-3(loại). Vậy pH = -lg(1,325.10-3) = 2,87. * Bài tập 2: Tính pH của dung dịch NH4OH 1M biết hằng số điện li của nó là Kb = 1,75.10-5. * Lời giải: – Ta có, phương trình phân li (t0 thời điển ban đầu, tcb thời điểm khi PT đijện li đạt trạng thái cân bằng): NH4OH rightleftharpoons NH4+ + OH- t0: 1 0 0 pli: x x x tcb: 1 – x x x Từ biểu thức tính Kb ta có: small K_b=frac{[NH_{4}^{+}][OH^-]}{[NH_4OH]} Leftrightarrow 1,76.10^{-5}=frac{x.x}{1-x} ⇒ x2 = 1,76.10-5 – 1,76.10-5x ⇒ x = 4,1864.10-3 (nhận) hoặc x = 4,2.10-3 (loại) Vậy pOH = -lg(4,1864.10-3) = 2,378 ⇒ pH = 14 – 2,378 = 11,62. (lưu ý: pOH + pH = 14). Như vậy với bài viết này các em đã có thể hiểu được Độ điện li là gì? Hằng số phân li là gì? phụ thuộc vào yếu tố nào? Chúc các em học tốt, mọi góp ý và thắc mắc các em hãy để lại nhận xét ở dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoághi nhận và hỗ trợ nhé. Đăng bởi: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/do-dien-li-la-gi-hang-so-phan-li-la-gi-phu-thuoc-vao-yeu-to-nao/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục