Hóa 10 bài 34: Bài tập luyện tập Oxi (O) Lưu huỳnh (S). Oxi (O) và Lưu huỳnh (S) là những nguyên tố phi kim quan trọng mà chúng ta đã được tìm hiểu về tính chất vật lý cũng như tính chất hóa học trong các bài học trước.
Bài này chúng ta cùng ôn tập lại một số kiến thức về Oxi và lưu huỳnh như cấu tạo nguyên tử, độ âm điện, số oxi hóa và tính chất hóa học của Oxi, Lưu huỳnh. Qua đó vận dụng giải một số bài tập về Oxi, lưu huỳnh.
Bạn đang xem bài: Hóa 10 bài 34: Bài tập luyện tập Oxi (O) Lưu huỳnh (S)
I. Cấu tạo tính chất của Oxi, Lưu huỳnh
1. Cấu hình Electron nguyên tử của Oxi, lưu huỳnh
– Nguyên tử Oxi: 1s22s22p4
– Nguyên tử Lưu huỳnh: 1s22s22p63s23p2
2. Độ âm điện của Oxi, lưu huỳnh
– Nguyên tử Oxi: 3,44
– Nguyên tử Lưu huỳnh: 2,58
3. Tính chất hóa học của Oxi, lưu huỳnh
a) Tính chất hóa học của Oxi
• Oxi thể hiện tính oxi hóa rất mạnh
– Oxi tác dụng với kim loại: 2Mg + O2 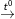 2MgO
2MgO
– Oxi tác dụng với phi kim: C + O2 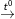 CO2
CO2
– Oxi tác dụng với hợp chất: CO + O2 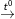 CO2
CO2
b) Tính chất hóa học của Lưu huỳnh
• Lưu huỳnh thể hiện tính oxi hóa mạnh:
– Lưu huỳnh tác dụng với kim loại: S + Fe 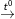 ) FeS
) FeS
– Lưu huỳnh tác dụng với phi kim: S + H2 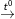 H2S
H2S
• Lưu huỳnh thể hiện tính khử với O và F:
S + O2 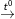 SO2
SO2
S + F2 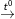 SF6
SF6
II. Tính chất hóa học các hợp chất của lưu huỳnh
1. Hidro Sunfua (H2S)
– Dung dịch H2S có tính axit yếu (axit sunfuahidric)
– H2S thể hiện tính khử mạnh:
H2S + O2 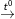 2S + 2H2O.
2S + 2H2O.
H2S + 3O2 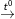 2SO2 + 2H2O
2SO2 + 2H2O
2. Lưu huỳnh Đioxit (SO2)
• SO2 là oxit axit:
SO2 + H2O 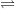 H2SO3
H2SO3
• SO2 thể hiện tính oxi hóa (khi tác dụng với chất khử mạnh hơn):
SO2 + 2H2S → 3S + 2H2O
• SO2 thể hiện tính khử (khi tác dụng với chất oxi hóa mạnh hơn):
SO2 + Br2 + 2H2O → 2HBr + H2SO4
* Lưu ý: Một số muối sunfua của kim loại nặng có màu đặc trưng như CdS màu vàng, CuS, FeS, Ag2S,… màu đen.
3. Lưu huỳnh trioxit (SO3)
• SO3 là oxit axit
SO3 + H2O → H2SO4 (axit sunfuric)
• Dung dịch axit sunfuric loãng: ion H+ đóng vai trò tác nhân oxi hóa
– Quỳ tím hoá đỏ
– Tác dụng với kim loại đứng trước H → muối + H2
– Tác dụng với bazơ và oxit bazơ → muối + H2O
– Tác dụng với muối của axit yếu hơn
• Dung dịch axit sunfuric đặc: ion SO42- đóng vai trò tác nhân oxi hóa.
2H2SO4 (đặc) + Cu → CuSO4 + SO2 + 2H2O
6H2SO4 (đặc,nóng) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
• Tính háo nước:
C12H22O11 ![small xrightarrow[]{H_{2}SO_{4(d)}} 1582019504w9dezsf113 1639447939](https://tmdl.edu.vn/wp-content/uploads/2023/03/1582019504w9dezsf113_1639447939.gif) 12C + 11H2O
12C + 11H2O
III. Bài tập về Oxi, Lưu huỳnh
* Bài 1 trang 146 SGK Hóa 10: Cho biết phương trình hóa học:
H2SO4 (đặc) + 8HI → 4I2 + H2S + 4H2O
Câu nào diễn tả không đúng tính chất các chất?
A. H2SO4 là chất oxi hóa, HI là chất khử
B. HI bị oxi hóa thành I2, H2SO4 bị khử thành H2S.
C. H2SO4 oxi hóa hóa HI thành I2 và nó bị khử thành H2S.
D. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI.
° Lời giải bài 1 trang 146 SGK Hóa 10:
◊ Chọn đáp án đúng: D. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI.
* Bài 2 trang 146 SGK Hóa 10: Cho các phương trình hóa học:
a) SO2 + 2H2O + Br2 → 2HBr + H2SO4
b) SO2 + H2O → H2SO3
c) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
d) SO2 + 2H2S → 3S + 2H2O
e) 2SO2 + O2 → 2SO3
Chọn câu trả lời đúng:
– SO2 là chất oxi hóa trong các phản ứng hóa học sau:
A. a, d, e; B. b, c; C. d.
– SO2 là chất khử trong các phản ứng hóa học sau:
A. b, d, c, e; B. a, c, e; C. a, d, e.
° Lời giải bài 2 trang 146 SGK Hóa 10:
◊ Chọn đáp án đúng lần lượt là: C và B
– SO2 là chất oxi hóa trong phản ứng:
(d) SO2 + 2H2S → 3S + 2H2O (S+4 → S0)
– SO2 là chất khử trong các phản ứng:
(a) SO2 + 2H2O + Br2 → 2HBr + H2SO4 (S+4 → S+6)
(c) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4 (S+4 → S+6)
(e) 2SO2 + O2 → 2SO3 (S+4 → S+6)
* Bài 3 trang 146 SGK Hóa 10: Khi khí H2S và axit H2SO4 tham gia các phản ứng oxi hóa – khử, người ta có nhận xét:
– Hidro sunfua chỉ thể hiện tính khử.
– Axit sunfuric chỉ thể hiện tính oxi hóa.
a) Hãy giải thích điều nhận xét trên.
b) Đối với mỗi chất, hãy dẫn ra một phản ứng hóa học để minh họa.
° Lời giải bài 3 trang 146 SGK Hóa 10:
a) Vì trong Hiđro sunfua (H2S) số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học minh họa:
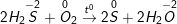
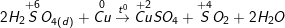
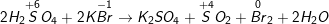
* Bài 4 trang 146 SGK Hóa 10: Khi có những chất sau: Sắt, lưu huỳnh, axit sunfuric loãng.
a) Hãy trình bày hai phương pháp điều chế hidro sunfua từ những chất đã cho.
b) Viết các phương trình phản ứng xảy ra và cho biết vai trò của lưu huỳnh trong các phản ứng
° Lời giải bài 4 trang 146 SGK Hóa 10:
a) Hai phương pháp điều chế H2S từ những chất trên
Fe + S → FeS (1)
FeS + H2SO4 → FeSO4 + H2S (2)
Fe + H2SO4 → FeSO4 + H2 (3)
H2 + S → H2S (4)
b) Vai trò của S trong phản ứng (1), (4) : S là chất oxi hóa.
* Bài 5 trang 147 SGK Hóa 10: Có 3 bình, mỗi bình đựng một chất khí là H2S, SO2, O2. Hãy trình bày phương pháp hóa học nhận biết chất khí đựng trong mỗi bình.
° Lời giải bài 5 trang 146 SGK Hóa 10:
– Dùng que đóm còn than hồng để nhận biết O2.
+ Tàn đóm bùng cháy ⇒ O2
+ Tàn đóm tắt ⇒ H2S, SO2
– Còn lại hai bình là H2S và SO2, sục 2 khí này vào dung dịch Ba(OH)2 dư:
+ Xuất hiện kết tủa trắng ⇒ SO2
+ Không hiện tượng ⇒ H2S
Ba(OH)2 + SO2 → BaSO3 + H2O
Ba(OH)2 + H2S → BaS + 2H2O
* Bài 6 trang 147 SGK Hóa 10: Có 3 bình, mỗi bình đựng một dung dịch sau: HCl, H2SO3, H2SO4. Có thể nhận biết dung dịch đựng trong mỗi bình bằng phương pháp hóa học với một thuốc thử nào sau đây:
a) Qùy tím. b) Natri hiđroxit. c) Bari hiđroxit.
d) Natri oxit. e) Cacbon đioxit.
Trình bày cách nhận biết sau khi chọn thuốc thử.
° Lời giải bài 6 trang 146 SGK Hóa 10:
◊ Chọn thuốc thử Ba(OH)2
• Cách nhận biết:
– Lấy mẫu thử ra các ống nghiệm và đánh số tương ứng.
– Nhỏ dung dịch vào các ống nghiệm chứa các mẫu thử:
+ Xuất hiện kết tủa trắng ⇒ H2SO3, H2SO4
+ Các phương trình hóa học:
Ba(OH)2 + H2SO3 → BaSO3↓+ H2O.
Ba(OH)2 + H2SO4 → BaSO4↓ + H2O.
+ Không hiện tượng ⇒ HCl
– Nhỏ dung dịch axit HCl vừa nhận biết được đến dư vào 2 kết tủa thu được:
+ Kết tủa tan, sủi bột khí ⇒ ống nghiệm ban đầu chứa H2SO3
+ PTHH: BaSO3 + 2HCl → BaCl2 + SO2 + H2O
+ Kết tủa không tan ⇒ ống nghiệm ban đầu chứa H2SO4
* Bài 7 trang 147 SGK Hóa 10: Có thể tồn tại đồng thời những chất sau trong một bình chứa được không?
a) Khí hiđro sunfua H2S và khí lưu huỳnh đioxit SO2
b) Khí oxi O2 và khí clo Cl2
c) Khí hiđro iotua HI và khí clo Cl2
Giải thích và viết phương trình phản ứng.
° Lời giải bài 7 trang 146 SGK Hóa 10:
a) Khí hiđro sunfua H2S và khí SO2 không cùng tồn tại trong một bình chứa vì H2S chất khử mạnh, SO2 là chất oxi hóa.
2H2S + SO2 → 3S + 2H2O
b) Khí oxi và khí clo có thể tồn tại trong một bình vì O2 không tác dụng trực tiếp với Cl2
c) Khí HI và Cl2 không tồn tại trong một bình vì Cl2 là chất oxi hóa mạnh và HI là chất khử mạnh
Cl2 + 2HI → 2HCl + I2
* Bài 8 trang 147 SGK Hóa 10: Nung nóng 3,72g hỗn hợp bột các kim loại Zn và Fe trong bột S dư. Chất rắn thu được sau phản ứng được hòa tan hoàn toàn bằng dung dịch H2SO4 loãng, nhận thấy có 1,344 lít khí (đktc) thoát ra.
a) Viết các phương trình phản ứng xảy ra.
b) Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu.
° Lời giải bài 8 trang 147 SGK Hóa 10:
– Theo bài ra, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4
– Gọi x, y lần lượt là số mol của Zn và Fe
– Theo bài ra, có 3,72g hỗn hợp Zn, Fe nên:
65x + 56y = 3,72 (1)
– Cũng theo bài ra, có 1,344 lít khí (đktc) thoát ra nên:
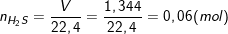
– Theo PTPƯ ta có: nZn + nFe = nH2S = x + y = 0,06 (2)
– Giải hệ từ phương trình (1) và (2) ta được: x = 0,04 mol, y = 0,02 mol.
– Khối lượng của Kẽm là: mZn = n.M = 0,04.65 = 2,6(g)
– Khối lượng của Sắt là: mFe = n.M = 0,02.56 = 1,12(g).
Hy vọng với bài viết về Bài tập luyện tập Oxi (O) Lưu huỳnh (S) ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại nội dung dưới phần bình luận để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
Xem thêm Hóa 10 bài 34
Hóa 10 bài 34: Bài tập luyện tập Oxi (O) Lưu huỳnh (S). Oxi (O) và Lưu huỳnh (S) là những nguyên tố phi kim quan trọng mà chúng ta đã được tìm hiểu về tính chất vật lý cũng như tính chất hóa học trong các bài học trước. Bài này chúng ta cùng ôn tập lại một số kiến thức về Oxi và lưu huỳnh như cấu tạo nguyên tử, độ âm điện, số oxi hóa và tính chất hóa học của Oxi, Lưu huỳnh. Qua đó vận dụng giải một số bài tập về Oxi, lưu huỳnh. I. Cấu tạo tính chất của Oxi, Lưu huỳnh 1. Cấu hình Electron nguyên tử của Oxi, lưu huỳnh – Nguyên tử Oxi: 1s22s22p4 – Nguyên tử Lưu huỳnh: 1s22s22p63s23p2 2. Độ âm điện của Oxi, lưu huỳnh – Nguyên tử Oxi: 3,44 – Nguyên tử Lưu huỳnh: 2,58 3. Tính chất hóa học của Oxi, lưu huỳnh a) Tính chất hóa học của Oxi • Oxi thể hiện tính oxi hóa rất mạnh – Oxi tác dụng với kim loại: 2Mg + O2 2MgO – Oxi tác dụng với phi kim: C + O2 CO2 – Oxi tác dụng với hợp chất: CO + O2 CO2 b) Tính chất hóa học của Lưu huỳnh • Lưu huỳnh thể hiện tính oxi hóa mạnh: – Lưu huỳnh tác dụng với kim loại: S + Fe ) FeS – Lưu huỳnh tác dụng với phi kim: S + H2 H2S • Lưu huỳnh thể hiện tính khử với O và F: S + O2 SO2 S + F2 SF6 II. Tính chất hóa học các hợp chất của lưu huỳnh 1. Hidro Sunfua (H2S) – Dung dịch H2S có tính axit yếu (axit sunfuahidric) – H2S thể hiện tính khử mạnh: H2S + O2 2S + 2H2O. H2S + 3O2 2SO2 + 2H2O 2. Lưu huỳnh Đioxit (SO2) • SO2 là oxit axit: SO2 + H2O H2SO3 • SO2 thể hiện tính oxi hóa (khi tác dụng với chất khử mạnh hơn): SO2 + 2H2S → 3S + 2H2O • SO2 thể hiện tính khử (khi tác dụng với chất oxi hóa mạnh hơn): SO2 + Br2 + 2H2O → 2HBr + H2SO4 * Lưu ý: Một số muối sunfua của kim loại nặng có màu đặc trưng như CdS màu vàng, CuS, FeS, Ag2S,… màu đen. 3. Lưu huỳnh trioxit (SO3) • SO3 là oxit axit SO3 + H2O → H2SO4 (axit sunfuric) • Dung dịch axit sunfuric loãng: ion H+ đóng vai trò tác nhân oxi hóa – Quỳ tím hoá đỏ – Tác dụng với kim loại đứng trước H → muối + H2 – Tác dụng với bazơ và oxit bazơ → muối + H2O – Tác dụng với muối của axit yếu hơn • Dung dịch axit sunfuric đặc: ion SO42- đóng vai trò tác nhân oxi hóa. 2H2SO4 (đặc) + Cu → CuSO4 + SO2 + 2H2O 6H2SO4 (đặc,nóng) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O • Tính háo nước: C12H22O11 12C + 11H2O III. Bài tập về Oxi, Lưu huỳnh * Bài 1 trang 146 SGK Hóa 10: Cho biết phương trình hóa học: H2SO4 (đặc) + 8HI → 4I2 + H2S + 4H2O Câu nào diễn tả không đúng tính chất các chất? A. H2SO4 là chất oxi hóa, HI là chất khử B. HI bị oxi hóa thành I2, H2SO4 bị khử thành H2S. C. H2SO4 oxi hóa hóa HI thành I2 và nó bị khử thành H2S. D. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI. ° Lời giải bài 1 trang 146 SGK Hóa 10: ◊ Chọn đáp án đúng: D. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI. * Bài 2 trang 146 SGK Hóa 10: Cho các phương trình hóa học: a) SO2 + 2H2O + Br2 → 2HBr + H2SO4 b) SO2 + H2O → H2SO3 c) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4 d) SO2 + 2H2S → 3S + 2H2O e) 2SO2 + O2 → 2SO3 Chọn câu trả lời đúng: – SO2 là chất oxi hóa trong các phản ứng hóa học sau: A. a, d, e; B. b, c; C. d. – SO2 là chất khử trong các phản ứng hóa học sau: A. b, d, c, e; B. a, c, e; C. a, d, e. ° Lời giải bài 2 trang 146 SGK Hóa 10: ◊ Chọn đáp án đúng lần lượt là: C và B – SO2 là chất oxi hóa trong phản ứng: (d) SO2 + 2H2S → 3S + 2H2O (S+4 → S0) – SO2 là chất khử trong các phản ứng: (a) SO2 + 2H2O + Br2 → 2HBr + H2SO4 (S+4 → S+6) (c) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4 (S+4 → S+6) (e) 2SO2 + O2 → 2SO3 (S+4 → S+6) * Bài 3 trang 146 SGK Hóa 10: Khi khí H2S và axit H2SO4 tham gia các phản ứng oxi hóa – khử, người ta có nhận xét: – Hidro sunfua chỉ thể hiện tính khử. – Axit sunfuric chỉ thể hiện tính oxi hóa. a) Hãy giải thích điều nhận xét trên. b) Đối với mỗi chất, hãy dẫn ra một phản ứng hóa học để minh họa. ° Lời giải bài 3 trang 146 SGK Hóa 10: a) Vì trong Hiđro sunfua (H2S) số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa). b) Phương trình phản ứng hóa học minh họa: * Bài 4 trang 146 SGK Hóa 10: Khi có những chất sau: Sắt, lưu huỳnh, axit sunfuric loãng. a) Hãy trình bày hai phương pháp điều chế hidro sunfua từ những chất đã cho. b) Viết các phương trình phản ứng xảy ra và cho biết vai trò của lưu huỳnh trong các phản ứng ° Lời giải bài 4 trang 146 SGK Hóa 10: a) Hai phương pháp điều chế H2S từ những chất trên Fe + S → FeS (1) FeS + H2SO4 → FeSO4 + H2S (2) Fe + H2SO4 → FeSO4 + H2 (3) H2 + S → H2S (4) b) Vai trò của S trong phản ứng (1), (4) : S là chất oxi hóa. * Bài 5 trang 147 SGK Hóa 10: Có 3 bình, mỗi bình đựng một chất khí là H2S, SO2, O2. Hãy trình bày phương pháp hóa học nhận biết chất khí đựng trong mỗi bình. ° Lời giải bài 5 trang 146 SGK Hóa 10: – Dùng que đóm còn than hồng để nhận biết O2. + Tàn đóm bùng cháy ⇒ O2 + Tàn đóm tắt ⇒ H2S, SO2 – Còn lại hai bình là H2S và SO2, sục 2 khí này vào dung dịch Ba(OH)2 dư: + Xuất hiện kết tủa trắng ⇒ SO2 + Không hiện tượng ⇒ H2S Ba(OH)2 + SO2 → BaSO3 + H2O Ba(OH)2 + H2S → BaS + 2H2O * Bài 6 trang 147 SGK Hóa 10: Có 3 bình, mỗi bình đựng một dung dịch sau: HCl, H2SO3, H2SO4. Có thể nhận biết dung dịch đựng trong mỗi bình bằng phương pháp hóa học với một thuốc thử nào sau đây: a) Qùy tím. b) Natri hiđroxit. c) Bari hiđroxit. d) Natri oxit. e) Cacbon đioxit. Trình bày cách nhận biết sau khi chọn thuốc thử. ° Lời giải bài 6 trang 146 SGK Hóa 10: ◊ Chọn thuốc thử Ba(OH)2 • Cách nhận biết: – Lấy mẫu thử ra các ống nghiệm và đánh số tương ứng. – Nhỏ dung dịch vào các ống nghiệm chứa các mẫu thử: + Xuất hiện kết tủa trắng ⇒ H2SO3, H2SO4 + Các phương trình hóa học: Ba(OH)2 + H2SO3 → BaSO3↓+ H2O. Ba(OH)2 + H2SO4 → BaSO4↓ + H2O. + Không hiện tượng ⇒ HCl – Nhỏ dung dịch axit HCl vừa nhận biết được đến dư vào 2 kết tủa thu được: + Kết tủa tan, sủi bột khí ⇒ ống nghiệm ban đầu chứa H2SO3 + PTHH: BaSO3 + 2HCl → BaCl2 + SO2 + H2O + Kết tủa không tan ⇒ ống nghiệm ban đầu chứa H2SO4 * Bài 7 trang 147 SGK Hóa 10: Có thể tồn tại đồng thời những chất sau trong một bình chứa được không? a) Khí hiđro sunfua H2S và khí lưu huỳnh đioxit SO2 b) Khí oxi O2 và khí clo Cl2 c) Khí hiđro iotua HI và khí clo Cl2 Giải thích và viết phương trình phản ứng. ° Lời giải bài 7 trang 146 SGK Hóa 10: a) Khí hiđro sunfua H2S và khí SO2 không cùng tồn tại trong một bình chứa vì H2S chất khử mạnh, SO2 là chất oxi hóa. 2H2S + SO2 → 3S + 2H2O b) Khí oxi và khí clo có thể tồn tại trong một bình vì O2 không tác dụng trực tiếp với Cl2 c) Khí HI và Cl2 không tồn tại trong một bình vì Cl2 là chất oxi hóa mạnh và HI là chất khử mạnh Cl2 + 2HI → 2HCl + I2 * Bài 8 trang 147 SGK Hóa 10: Nung nóng 3,72g hỗn hợp bột các kim loại Zn và Fe trong bột S dư. Chất rắn thu được sau phản ứng được hòa tan hoàn toàn bằng dung dịch H2SO4 loãng, nhận thấy có 1,344 lít khí (đktc) thoát ra. a) Viết các phương trình phản ứng xảy ra. b) Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu. ° Lời giải bài 8 trang 147 SGK Hóa 10: – Theo bài ra, bột S dư nên Fe và Zn tác dụng hết với S. a) Phương trình hóa học của phản ứng: Zn + S → ZnS Fe + S → FeS ZnS + H2SO4 → ZnSO4 + H2S FeS + H2SO4 → H2S + FeSO4 – Gọi x, y lần lượt là số mol của Zn và Fe – Theo bài ra, có 3,72g hỗn hợp Zn, Fe nên: 65x + 56y = 3,72 (1) – Cũng theo bài ra, có 1,344 lít khí (đktc) thoát ra nên: – Theo PTPƯ ta có: nZn + nFe = nH2S = x + y = 0,06 (2) – Giải hệ từ phương trình (1) và (2) ta được: x = 0,04 mol, y = 0,02 mol. – Khối lượng của Kẽm là: mZn = n.M = 0,04.65 = 2,6(g) – Khối lượng của Sắt là: mFe = n.M = 0,02.56 = 1,12(g). Hy vọng với bài viết về Bài tập luyện tập Oxi (O) Lưu huỳnh (S) ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại nội dung dưới phần bình luận để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt. Đăng bởi: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-10-bai-34-bai-tap-luyen-tap-oxi-o-luu-huynh-s/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục