Hóa 10 bài 7: Bảng tuần hoàn các nguyên tốt hóa học: Nguyên tắc sắp xếp và Cấu tạo bảng tuần hoàn. Thời trung cổ, loài người đã biết các nguyên tố vàng, bạc, đồng, chì sắt, thủy ngân và lưu huỳnh. Trải qua thời gian nhiều nguyên tố mới được tìm ra, và một số nhà khoa học đã tìm ra quy luật để sắp xếp các nguyên tố hóa học.
Cho đến năm 1860 nhà bác học người Nga Men-đê-lê-ép đã đề xuất ý tưởng xây dựng bảng tuần hoàn các nguyên tố hóa học. Năm 1869, ông công bố bản “Bảng tuần hoàn các nguyên tố hóa học” đầu tiên.
Bạn đang xem bài: Hóa 10 bài 7: Bảng tuần hoàn các nguyên tốt hóa học: Nguyên tắc sắp xếp và Cấu tạo bảng tuần hoàn
Vậy các nguyên tố hóa học được xếp vào bảng tuần hoàn các nguyên tố hóa học theo nguyên tắc nào? Bảng tuần hoàn các nguyên tố hóa học có cấu tạo như thế nào? chúng ta cùng tìm hiểu qua bài viết dưới đây.
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Các nguyên tố hóa học được xếp vào bảng tuần hoàn dựa trên 3 nguyên tắc sau:
– Nguyên tắc 1: Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân.
– Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng ngang (chu kì).
– Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị (electron có khả năng tham gia vào quá trình hình thành liên kết hóa học) được xếp thành một cột (nhóm).
Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học (electron lớp ngoài cùng hoặc phân lớp kế ngoài cùng chưa bão hòa).

II. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tố
– Mỗi nguyên tố hóa học được xếp vào một ô của bảng gọi là ô nguyên tố.
– Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân).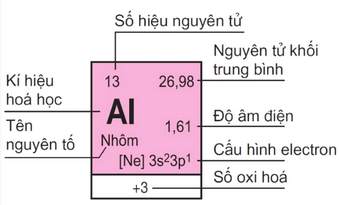
2. Chu kì
• Định nghĩa: Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
+ Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
– Chu kì: 1, 2, 3 là các chu kì nhỏ
– Chu kì: 4, 5, 6, 7 là các chu kì lớn
– Ví dụ: 12Mg: 1s22s22p63s2
⇒ Mg thuộc chu kì 3 vì có 3 lớp electron.
* Nhận xét:
– Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau và bằng số thứ tự của chu kì.
– Mở đầu chu kì là kim loại kiềm, gần cuối chu kì là halogen (trừ chu kì 1); cuối chu kì là khí hiếm.
– 2 hàng cuối bảng là 2 họ nguyên tố có cấu hình electron đặc biệt: Lantan và Actini.
Họ Lantan: gồm 14 nguyên tố đứng sau La (Z = 57) thuộc chu kì 6.
Họ Actini: gồm 14 nguyên tố sau Ac (Z = 89) thuộc chu kì 7.
3. Nhóm nguyên tố
• Định nghĩa: Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
• Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
* Nhóm A:
– Nhóm A gồm 8 nhóm từ IA đến VIIIA.
– Các nguyên tố nhóm A gồm nguyên tố s và nguyên tố p:
+ Nguyên tố s: Nhóm IA (nhóm kim loại kiềm, trừ H) và nhóm IIA (kim loại kiềm thổ).
+ Nguyên tố p: Nhóm IIIA đến VIIIA (trừ He).
– STT nhóm A = Tổng số e lớp ngoài cùng = Số e hóa trị
+ Cấu hình electron hóa trị tổng quát của nhóm A:
→ nsanpb
→ ĐK:1≤a≤2; 0≤b≤6
+ Số thứ tự của nhóm A=a+b
→ Nếu a+b≤3 ⇒ Kim loại
→ Nếu 5≤a+b≤7 ⇒ Phi kim
→ Nếu a+b=8 ⇒ Khí hiếm
– Ví dụ: → Na (Z=11): 1s22s22p63s1 ⇒ IA
→ O (Z=8): 1s22s22p4 ⇒ VIA
* Nhóm B:
– Nhóm B gồm 8 nhóm được đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn.
– Nhóm B chỉ gồm các nguyên tố của các chu kỳ lớn.
– Nhóm B gồm các nguyên tố d và nguyên tố f (thuộc 2 hàng cuối bảng).
– STT nhóm = Tổng số e lớp ngoài cùng = Số e hóa trị
(Ngoại lệ: Số e hóa trị = 9,10 thuộc nhóm VIIIB)
+ Cấu hình electron hóa trị của nguyên tố d:
→ (n−1)dansb
→ ĐK:b=2;1≤a≤10
→ Nếu a+b<8 ⇒ STT nhóm =a+b hay: nguyên tố thuộc nhóm (a+b)B
→ Nếu a+b=8,9,10 ⇒ STT nhóm =8 hay: nguyên tố thuộc nhóm VIIIB
→ Nếu a+b>10 ⇒ STT nhóm =(a+b)−10 hay: nguyên tố thuộc nhóm (a+b-10)B
• Khối các nguyên tố s, p, d, f
+ Khối các nguyên tố s: gồm các nguyên tố nhóm IA và IIA
– Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
– Ví dụ: 11Na: 1s22s22p63s1
+ Khối các nguyên tố p: gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He).
– Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
– Ví dụ: 13Al: 1s22s22p63s2 3p1
+ Khối các nguyên tố d: gồm các nguyên tố thuộc nhóm B.
– Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
– Ví dụ: 26Fe: 1s22s22p63s2 3p63d64s2
+ Khối các nguyên tố f: gồm các nguyên tố thuộc họ Lantan và họ Actini.
– Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
– Ví dụ: 58Ce: 1s22s22p63s2 3p63d104s24p64f25s25p66s2
III. Bài tập vận dụng Bảng tuần hoàn các nguyên tố hóa học
* Bài 1 trang 35 SGK Hóa 10: Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là:
A. 3; B. 5; C. 6; D. 7;
Chọn đáp số đúng.
Cần nhớ: Số thứ tự của chu kì bằng số lớp electron
Số thứ tự của nhóm bằng số e hóa trị
* Lời giải:
– Đáp án đúng: C. 6;
Số lớp electron của nguyên tố là chu kì của nguyên tố đó.
* Bài 2 trang 35 SGK Hóa 10: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là:
A. 3 và 3; B. 3 và 4; C. 4 và 4; D. 4 và 3;
Chọn đáp số đúng.
* Lời giải:
– Đáp án đúng: B. 3 và 4;
* Bài 3 trang 35 SGK Hóa 10: Số nguyên tố trong chu kì 3 và 5 là:
A. 8 và 18; B. 18 và 8; C. 8 và 8; D. 18 và 18;
Chọn đáp số đúng.
* Lời giải:
– Đáp án đúng: A. 8 và 18;
* Bài 4 trang 35 SGK Hóa 10: Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc:
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
C. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành 1 cột.
D. Cả A, B, C.
Chọn đáp án đúng.
* Lời giải:
– Chọn đáp án: D. Cả A, B, C.
* Bài 5 trang 35 SGK Hóa 10: Tìm câu SAI trong các câu sau đây:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm.
B. Chu kì là dãy các nguyên tố mà những nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
C. Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
D. Bảng tuần hoàn có 8 nhóm A và 8 nhóm B.
* Lời giải:
– Câu sai: C. Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
* Bài 6 trang 35 SGK Hóa 10: Hãy cho biết nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học.
* Lời giải:
– Nguyên tắc 1: Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
– Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng.
– Nguyên tắc 3: Các nguyên tố có số electron hóa trị được xếp thành một cột.
* Bài 7 trang 35 SGK Hóa 10: a) Nhóm nguyên tố là gì?
b) Bảng tuần hoàn các nguyên tố có bao nhiêu cột?
c) Bảng tuần hoàn có bao nhiêu nhóm A?
d) Bảng tuần hoàn có bao nhiêu nhóm B? Các nhóm B gồm bao nhiêu cột?
e) Những nhóm nào chứa nguyên tố s? Những nhóm nào chứa nguyên tố p? Những nhóm nào chứa nguyên tố d?
* Lời giải:
a) Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và xếp thành một cột.
b) Bảng tuần hoàn có 18 cột.
c) Bảng tuần hoàn có 8 nhóm A.
d) Bảng tuần hoàn có 8 nhóm B, gồm 10 cột.
e) Nhóm IA và IIA chứa nguyên tố s, nhóm IIIA đến nhóm VIIIA (trừ He) chứa các nguyên tố p. Các nhóm từ IIIB đến IIB (theo chiều từ trái qua phải trong bảng tuần hoàn) chứa các nguyên tố d.
* Bài 8 trang 35 SGK Hóa 10: Hãy cho biết quan hệ giữa số thứ tự của nhóm A và số electron hóa trị trong nguyên tử của các nguyên tố trong nhóm.
* Lời giải:
– Số thứ tự của các nhóm A trùng với số electron hóa trị trong nguyên tử của các nguyên tố trong nhóm.
* Bài 9 trang 35 SGK Hóa 10: Hãy cho biết số electron thuộc lớp ngoài cùng của nguyên tử các nguyên tố Li, Be, B, C, N, O, F, Ne.
* Lời giải:
– Số electron thuộc lớp ngoài của nguyên tử các nguyên tố Li: 1e, Be : 2e, B: 3e, C: 4e, N: 5e, O: 6e, F: 7e, Ne: 8e.
Hy vọng khi đọc tới đây các em đã có thể dễ dàng trả lời bảng tuần hoàn các nguyên tố hóa học theo nguyên tắc nào? Bảng tuần hoàn các nguyên tố hóa học có cấu tạo như thế nào? Chúc các em học tốt, mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ nhé.
Xem thêm Hóa 10 bài 7
Hóa 10 bài 7: Bảng tuần hoàn các nguyên tốt hóa học: Nguyên tắc sắp xếp và Cấu tạo bảng tuần hoàn. Thời trung cổ, loài người đã biết các nguyên tố vàng, bạc, đồng, chì sắt, thủy ngân và lưu huỳnh. Trải qua thời gian nhiều nguyên tố mới được tìm ra, và một số nhà khoa học đã tìm ra quy luật để sắp xếp các nguyên tố hóa học. Cho đến năm 1860 nhà bác học người Nga Men-đê-lê-ép đã đề xuất ý tưởng xây dựng bảng tuần hoàn các nguyên tố hóa học. Năm 1869, ông công bố bản “Bảng tuần hoàn các nguyên tố hóa học” đầu tiên. Vậy các nguyên tố hóa học được xếp vào bảng tuần hoàn các nguyên tố hóa học theo nguyên tắc nào? Bảng tuần hoàn các nguyên tố hóa học có cấu tạo như thế nào? chúng ta cùng tìm hiểu qua bài viết dưới đây. I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn Các nguyên tố hóa học được xếp vào bảng tuần hoàn dựa trên 3 nguyên tắc sau: – Nguyên tắc 1: Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân. – Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng ngang (chu kì). – Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị (electron có khả năng tham gia vào quá trình hình thành liên kết hóa học) được xếp thành một cột (nhóm). Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học (electron lớp ngoài cùng hoặc phân lớp kế ngoài cùng chưa bão hòa). II. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học 1. Ô nguyên tố – Mỗi nguyên tố hóa học được xếp vào một ô của bảng gọi là ô nguyên tố. – Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân). 2. Chu kì • Định nghĩa: Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần. + Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó. – Chu kì: 1, 2, 3 là các chu kì nhỏ – Chu kì: 4, 5, 6, 7 là các chu kì lớn – Ví dụ: 12Mg: 1s22s22p63s2 ⇒ Mg thuộc chu kì 3 vì có 3 lớp electron. * Nhận xét: – Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau và bằng số thứ tự của chu kì. – Mở đầu chu kì là kim loại kiềm, gần cuối chu kì là halogen (trừ chu kì 1); cuối chu kì là khí hiếm. – 2 hàng cuối bảng là 2 họ nguyên tố có cấu hình electron đặc biệt: Lantan và Actini. Họ Lantan: gồm 14 nguyên tố đứng sau La (Z = 57) thuộc chu kì 6. Họ Actini: gồm 14 nguyên tố sau Ac (Z = 89) thuộc chu kì 7. 3. Nhóm nguyên tố • Định nghĩa: Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột. • Có 2 loại nhóm nguyên tố là nhóm A và nhóm B: * Nhóm A: – Nhóm A gồm 8 nhóm từ IA đến VIIIA. – Các nguyên tố nhóm A gồm nguyên tố s và nguyên tố p: + Nguyên tố s: Nhóm IA (nhóm kim loại kiềm, trừ H) và nhóm IIA (kim loại kiềm thổ). + Nguyên tố p: Nhóm IIIA đến VIIIA (trừ He). – STT nhóm A = Tổng số e lớp ngoài cùng = Số e hóa trị + Cấu hình electron hóa trị tổng quát của nhóm A: → nsanpb → ĐK:1≤a≤2; 0≤b≤6 + Số thứ tự của nhóm A=a+b → Nếu a+b≤3 ⇒ Kim loại → Nếu 5≤a+b≤7 ⇒ Phi kim → Nếu a+b=8 ⇒ Khí hiếm – Ví dụ: → Na (Z=11): 1s22s22p63s1 ⇒ IA → O (Z=8): 1s22s22p4 ⇒ VIA * Nhóm B: – Nhóm B gồm 8 nhóm được đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn. – Nhóm B chỉ gồm các nguyên tố của các chu kỳ lớn. – Nhóm B gồm các nguyên tố d và nguyên tố f (thuộc 2 hàng cuối bảng). – STT nhóm = Tổng số e lớp ngoài cùng = Số e hóa trị (Ngoại lệ: Số e hóa trị = 9,10 thuộc nhóm VIIIB) + Cấu hình electron hóa trị của nguyên tố d: → (n−1)dansb → ĐK:b=2;1≤a≤10 → Nếu a+b<8 ⇒ STT nhóm =a+b hay: nguyên tố thuộc nhóm (a+b)B → Nếu a+b=8,9,10 ⇒ STT nhóm =8 hay: nguyên tố thuộc nhóm VIIIB → Nếu a+b>10 ⇒ STT nhóm =(a+b)−10 hay: nguyên tố thuộc nhóm (a+b-10)B • Khối các nguyên tố s, p, d, f + Khối các nguyên tố s: gồm các nguyên tố nhóm IA và IIA – Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s. – Ví dụ: 11Na: 1s22s22p63s1 + Khối các nguyên tố p: gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He). – Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p. – Ví dụ: 13Al: 1s22s22p63s2 3p1 + Khối các nguyên tố d: gồm các nguyên tố thuộc nhóm B. – Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d. – Ví dụ: 26Fe: 1s22s22p63s2 3p63d64s2 + Khối các nguyên tố f: gồm các nguyên tố thuộc họ Lantan và họ Actini. – Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f. – Ví dụ: 58Ce: 1s22s22p63s2 3p63d104s24p64f25s25p66s2 III. Bài tập vận dụng Bảng tuần hoàn các nguyên tố hóa học * Bài 1 trang 35 SGK Hóa 10: Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là: A. 3; B. 5; C. 6; D. 7; Chọn đáp số đúng. Cần nhớ: Số thứ tự của chu kì bằng số lớp electron Số thứ tự của nhóm bằng số e hóa trị * Lời giải: – Đáp án đúng: C. 6; Số lớp electron của nguyên tố là chu kì của nguyên tố đó. * Bài 2 trang 35 SGK Hóa 10: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là: A. 3 và 3; B. 3 và 4; C. 4 và 4; D. 4 và 3; Chọn đáp số đúng. * Lời giải: – Đáp án đúng: B. 3 và 4; * Bài 3 trang 35 SGK Hóa 10: Số nguyên tố trong chu kì 3 và 5 là: A. 8 và 18; B. 18 và 8; C. 8 và 8; D. 18 và 18; Chọn đáp số đúng. * Lời giải: – Đáp án đúng: A. 8 và 18; * Bài 4 trang 35 SGK Hóa 10: Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc: A. Theo chiều tăng của điện tích hạt nhân. B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng. C. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành 1 cột. D. Cả A, B, C. Chọn đáp án đúng. * Lời giải: – Chọn đáp án: D. Cả A, B, C. * Bài 5 trang 35 SGK Hóa 10: Tìm câu SAI trong các câu sau đây: A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm. B. Chu kì là dãy các nguyên tố mà những nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần. C. Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử. D. Bảng tuần hoàn có 8 nhóm A và 8 nhóm B. * Lời giải: – Câu sai: C. Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử. * Bài 6 trang 35 SGK Hóa 10: Hãy cho biết nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học. * Lời giải: – Nguyên tắc 1: Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân. – Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng. – Nguyên tắc 3: Các nguyên tố có số electron hóa trị được xếp thành một cột. * Bài 7 trang 35 SGK Hóa 10: a) Nhóm nguyên tố là gì? b) Bảng tuần hoàn các nguyên tố có bao nhiêu cột? c) Bảng tuần hoàn có bao nhiêu nhóm A? d) Bảng tuần hoàn có bao nhiêu nhóm B? Các nhóm B gồm bao nhiêu cột? e) Những nhóm nào chứa nguyên tố s? Những nhóm nào chứa nguyên tố p? Những nhóm nào chứa nguyên tố d? * Lời giải: a) Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và xếp thành một cột. b) Bảng tuần hoàn có 18 cột. c) Bảng tuần hoàn có 8 nhóm A. d) Bảng tuần hoàn có 8 nhóm B, gồm 10 cột. e) Nhóm IA và IIA chứa nguyên tố s, nhóm IIIA đến nhóm VIIIA (trừ He) chứa các nguyên tố p. Các nhóm từ IIIB đến IIB (theo chiều từ trái qua phải trong bảng tuần hoàn) chứa các nguyên tố d. * Bài 8 trang 35 SGK Hóa 10: Hãy cho biết quan hệ giữa số thứ tự của nhóm A và số electron hóa trị trong nguyên tử của các nguyên tố trong nhóm. * Lời giải: – Số thứ tự của các nhóm A trùng với số electron hóa trị trong nguyên tử của các nguyên tố trong nhóm. * Bài 9 trang 35 SGK Hóa 10: Hãy cho biết số electron thuộc lớp ngoài cùng của nguyên tử các nguyên tố Li, Be, B, C, N, O, F, Ne. * Lời giải: – Số electron thuộc lớp ngoài của nguyên tử các nguyên tố Li: 1e, Be : 2e, B: 3e, C: 4e, N: 5e, O: 6e, F: 7e, Ne: 8e. Hy vọng khi đọc tới đây các em đã có thể dễ dàng trả lời bảng tuần hoàn các nguyên tố hóa học theo nguyên tắc nào? Bảng tuần hoàn các nguyên tố hóa học có cấu tạo như thế nào? Chúc các em học tốt, mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ nhé. Đăng bởi: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-10-bai-7-bang-tuan-hoan-cac-nguyen-tot-hoa-hoc-nguyen-tac-sap-xep-va-cau-tao-bang-tuan-hoan/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục