Hoá 11 bài 45: Tính chất hoá học của axit Cacboxylic, công thức cấu tạo và bài tập vận dụng. Axit Cacboxylic là hợp chất hữu cơ trong phân tử có nhóm chức -COOH được ứng dụng để chế xà phòng, tổng hợp phẩm nhuộm, nông dược,… axit salixylic dùng để chế thuốc cảm, thuốc xoa bóp, giảm đau,…
Vậy các axit cacboxylic có tính chất hoá học gì đặc trưng, được điều chế như thế nào và có những ứng dụng cụ thể nào, chúng ta cùng tìm hiểu qua bài viết dưới đây và vận dụng kiến thức vừa có giải các bài tập về axit cacboxylic.
Bạn đang xem bài: Hoá 11 bài 45: Tính chất hoá học của axit Cacboxylic, công thức cấu tạo và bài tập vận dụng
I. Axit Carboxylic – Định nghĩa, phân loại, danh pháp.
1. Axit carboxylic là gì?
– Định nghĩa: Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm – COOH liên kết với gốc hiđrocacbon, với H hoặc với nhau.
– Công thức cấu tạo của axit carboxylic: 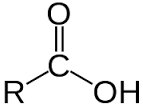
– Nhóm -COOH là nhóm chức của cacboxylic
2. Phân loại axit carboxylic
– Dựa vào đặc điểm của gốc hidrocacbon và số nhóm cacboxyl trong phân tử mà các axit được chia thành:
• Axit no đơn chức: CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1).
• Axit hữu cơ không no, mạch hở, đơn chức trong gốc hiđrocacbon có 1 liên kết đôi: CnH2n-1COOH (n ≥ 2) hoặc CmH2m-2O2 (m ≥ 3).
• Axit hữu cơ no, 2 chức, mạch hở: CnH2n(COOH)2 (n ≥ 0).
3. Cách gọi tên Cacboxylic – Danh pháp
a) Tên thay thế
Tên thay thế = Tên hiđrocacbon tương ứng + oic
b) Tên thường của một số axit thường gặp
| Công thức | Tên gọi |
| HCOOH | Axit fomic |
| CH3COOH | Axit axetic |
| CH3CH2COOH | Axit propionic |
| CH3CH2CH2COOH | Axit butiric |
| CH2=CH-COOH | Axit acrylic |
| CH2=C(CH3)-COOH | Axit metacrylic |
| (COOH)2 | Axit oxalic |
| C6H5COOH | Axit benzoic |
| HOOC(CH2)4COOH | Axit ađipic |
| C15H31COOH | Axit pamitic |
| C17H35COOH | Axit stearic |
| C17H33COOH | Axit oleic |
| C17H31COOH | Axit linoleic |
II. Tính chất hoá học và tính chất vật lý của Axit Carboxylic
1. Tính chất vật lý của Axit Carboxylic
– Axit có nhiệt độ sôi cao hơn Ancol có khối lượng phân tử tương đương vì phân tử axit tạo được 2 liên kết H và liên kết H giữa các phân tử axit bền hơn liên kết H giữa các phân tử Ancol.
– Từ C1 đến C3 tan vô hạn trong nước do có khả năng tạo liên kết H liên phân tử với nước.
– C4 đến C5 ít tan trong nước; từ C6 trở lên không tan do gốc R cồng kềnh và có tính kị nước.
2. Tính chất hoá học của Axit Carboxylic
a) Tính axit của Cacboxylic
* So sánh tính axit giữa các phân tử axit
– Phân tử axit có nhóm cacbonyl C = O là nhóm hút e mạnh nên làm giảm mật độ e tự do trên nguyên tử O làm cho liên kết O – H bị phân cực hơn → dễ bị phân li thành H+ thể hiện tính axit.
RCOOH ↔ RCOO– + H+
(RCOOH + H2O ↔ RCOO– + H3O+)
– Độ mạnh của axit phụ thuộc vào độ linh động của nguyên tử H và độ tan của axit trong dung môi nước.
– Nếu nhóm COOH gắn với nhóm đẩy e (gốc hiđrocacbon no) thì tính axit yếu hơn so với HCOOH. Gốc ankyl càng có nhiều nguyên tử H thì đẩy e càng mạnh làm cho tính axit càng giảm.
– Nếu nhóm COOH gắn với nhóm hút e (gốc hiđrocacbon không no, gốc có chứa nhóm NO2, halogen, OH…) thì tính axit mạnh hơn so với HCOOH. Càng nhiều gốc hút e thì tính axit càng mạnh. Gốc hút e càng mạnh thì tính axit càng mạnh, nhóm hút e nằm càng gần nhóm COOH thì làm cho tính axit của axit càng mạnh.
* Các phản ứng thể hiện tính axit
– Axit làm quỳ tím chuyển thành màu hồng.
– Tác dụng với bazơ → muối + H2O
R(COOH)x + xNaOH → R(COONa)x + xH2O
CH3COOH + NaOH → CH3COONa + H2O
– Tác dụng với oxit bazơ → muối + H2O
2R(COOH)x + xNa2O → 2R(COONa)x + xH2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
– Tác dụng với kim loại đứng trước H → muối + H2
2R(COOH)x + xMg → [2R(COO)x]Mgx + xH2↑
2CH3COOH + Mg → (CH3COO)2Mg + H2↑
⇒ Phản ứng này có thể dùng để nhận biết axit.
– Tác dụng với muối của axit yếu hơn (muối cacbonat, phenolat, ancolat) → muối mới + axit mới.
R(COOH)x + xNaHCO3 → R(COONa)x + xH2O + xCO2↑
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2↑
⇒ Thường dùng muối cacbonat hoặc hiđrocacbonat để nhận biết các axit.
b) Phản ứng este hóa
R(COOH)x + R’(OH)y ![small xrightarrow[]{H_{2}SO_{4},t^{0}} 1552463181jgivmlfmwt](https://tmdl.edu.vn/wp-content/uploads/2023/03/1552463181jgivmlfmwt.gif) Ry(COO)xyR’x + xyH2O
Ry(COO)xyR’x + xyH2O
CH3CO-OH + H-O-C2H5 ![small xrightarrow[]{H_{2}SO_{4},t^{0}} 1552463181jgivmlfmwt](https://tmdl.edu.vn/wp-content/uploads/2023/03/1552463181jgivmlfmwt.gif) CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
c) Phản ứng tách nước
2RCOOH ![small xrightarrow[]{P_{2}O_{5}} 1552463184eqwu019u90](https://tmdl.edu.vn/wp-content/uploads/2023/03/1552463184eqwu019u90.gif) (RCO)2O + H2O
(RCO)2O + H2O
d) Phản ứng oxi hóa hoàn toàn
CxHyOz + (x + y/4 – z/2)O2 → xCO2 + y/2H2O
– Nếu đốt cháy axit thu được nCO2 = nH2O thì axit thuộc loại no, đơn chức, mạch hở:
CnH2n+1COOH → (n + 1)CO2 + (n + 1)H2O
+ Chú ý: HCOOH có phản ứng tương tự như anđehit:
HCOOH + 2AgNO3 + 4NH3 + H2O → 2NH4NO3 + (NH4)2CO3 + 2Ag
– Các axit không no còn có các tính chất của hiđrocacbon tương ứng:
CH2=CH-COOH + Br2 dung dịch → CH2Br-CHBr-COOH
3CH2=CH-COOH + 2KMnO4 + 4H2O → 3CH2OH-CHOH-COOH + 2MnO2 + 2KOH
+ Sản phẩm cộng của CH2 = CH – COOH với HX trái với Markovnikov
– Axit thơm có phản ứng thế vào vị trí meta.
– Axit no có phản ứng thế vào vị trí α.
III. Cách Điều chế, nhận biết và ứng dụng của Axit cacboxylic
1. Điều chế Axit cacboxylic
a) Oxi hóa anđehit
R(CHO)x + x/2O2 → R(COOH)x (xúc tác Mn2+, t0)
b) Thủy phân este trong môi trường axit
Ry(COO)xyR’x + xyH2O ↔ yR(COOH)x + xR’(OH)y
c) Thủy phân dẫn xuất 1,1,1 – trihalogen
RCCl3 + 3NaOH → RCOOH + 3NaCl + H2O (H2O)
d) Riêng CH3COOH
n-C4H10 + 5/2O2 ![small xrightarrow[]{Mn^{2+},t^{0}} 15524517064j0hazsouf](https://tmdl.edu.vn/wp-content/uploads/2023/03/15524517064j0hazsouf.gif) 2CH3COOH + H2O
2CH3COOH + H2O
C2H5OH + O2 –men giấm→ CH3COOH + H2O
e) Một số phản ứng khác
C6H5-CH3 → C6H5COOK → C6H5COOH
R-X → R-CN → R-COOH
CH3OH + CO → CH3COOH
2. Cách nhận biết Axit cacboxylic
– Làm quỳ tím chuyển thành màu đỏ; tác dụng với kim loại giải phóng H2; tác dụng với muối cacbonat hoặc hiđrocacbonat giải phóng khí CO2.
– Axit không no làm mất màu dung dịch Br2, dung dịch thuốc tím.
– HCOOH có phản ứng tương tự andehit: tạo được kết tủa trắng với AgNO3/NH3,…
3. Ứng dụng của Axit cacboxylic
a) Axit axetic
– Axit axetic được dùng để điều chế những chất có ứng dụng quan trọng như: axit cloaxetic (dùng tổng hợp chất diệt cỏ 2,4-D; 2,4,5-T … ), muối axetat của nhôm, crom, sắt (dùng làm chất cầm màu khi nhuộm vải, sợi), một số este (làm dược liệu, hương liệu, dung môi,…), xenlulozơ axetat (chế tơ axetat),…
b) Các axit cacboxylic khác
– Các axit béo như axit panmitic C15H31COOH, axit stearic C17H35COOH,… được dùng để chế xà phòng. Axit benzoic được dùng trong tổng hợp phẩm nhuộm, nông dược,… Axit salixylic dùng để chế thuốc cảm, thuốc xoa bóp, giảm đau,…
– Các axit đicacboxylic (như axit ađipic, axit phtalic,…) được dùng trong sản xuất poliamit, polieste để chế tơ sợi tổng hợp.
IV. Bài tập về Axit Cacboxylic
Bài 3 trang 210 SGK Hóa 11: Từ metan và các chất vô cơ cần thiết khác có thể điều chế được axit fomic, axit axetic. Viết phương trình hóa học của các phản ứng xảy ra.
* Lời giải bài 3 trang 210 SGK Hóa 11:
– Các phương trình phản ứng từ metan điều chế axit fomic:
CH4 + Cl2 ![small xrightarrow[]{as',1:1}](https://tmdl.edu.vn/wp-content/uploads/2023/03/1552451711b7mqxtb267.gif) CH3Cl + HCl
CH3Cl + HCl
CH3Cl + Cl2 ![small dpi{100} fn_cm small xrightarrow[]{t^{0}} 15524517175yhmss5jjl](https://tmdl.edu.vn/wp-content/uploads/2023/03/15524517175yhmss5jjl.gif) CH3OH + NaCl
CH3OH + NaCl
CH3OH + CuO ![small dpi{100} fn_cm small xrightarrow[]{t^{0}} 15524517175yhmss5jjl](https://tmdl.edu.vn/wp-content/uploads/2023/03/15524517175yhmss5jjl.gif) HCHO + Cu + H2O
HCHO + Cu + H2O
2HCHO + O2 ![small dpi{100} fn_cm small dpi{100} fn_cm small xrightarrow[]{t^{0},xt}](https://tmdl.edu.vn/wp-content/uploads/2023/03/155245172327w8wtpxe7.gif) 2HCOOH
2HCOOH
– Các phương trình phản ứng từ metan điều chế axit axetic:
2CH4 – làm lạnh nhanh, 1500 độ C→ C2H2 + 3H2
C2H2 + H2 ![small dpi{100} fn_cm small dpi{100} fn_cm small dpi{100} fn_cm small dpi{100} fn_cm small xrightarrow[]{t^{0},Pd,PbCO_{3}} 1552451726oa08sdge5t](https://tmdl.edu.vn/wp-content/uploads/2023/03/1552451726oa08sdge5t.gif) C2H4
C2H4
CH2-CH2 + HOH ![small dpi{100} fn_cm small dpi{100} fn_cm small xrightarrow[]{t^{0},xt}](https://tmdl.edu.vn/wp-content/uploads/2023/03/155245172327w8wtpxe7.gif) C2H5-OH
C2H5-OH
C2H5-OH + O2 ![small dpi{100} fn_cm small dpi{100} fn_cm small dpi{100} fn_cm small xrightarrow[]{enzim} 1552451733lhsdsaspbi](https://tmdl.edu.vn/wp-content/uploads/2023/03/1552451733lhsdsaspbi.gif) CH3-COOH + H2O
CH3-COOH + H2O
Bài 4 trang 210 SGK Hóa 11: Chất Y có công thức phân tử C4H8O2 tác dụng với NaOH tạo thành chất Z (C4H7O2Na). Vậy Y thuộc loại hợp chất nào sau đây?
A. Anđehit ; B. Axit. C. Ancol ; D. Xeton.
* Lời giải bài 4 trang 210 SGK Hóa 11:
– Đáp án: B. Axit
– Phương trình phản ứng minh họa:
CH3CH2CH2COOH + NaOH → CH3CH2CH2COONa + H2O
Bài 5 trang 210 SGK Hóa 11: Để trung hòa 150,0 gam dung dịch 7,40% của axit no, mạch hở, đơn chức X cần dùng 100,0 ml dung dịch NaOH 1,50M. Viết công thức cấu tạo và gọi tên của chất X.
*Lời giải bài 5 trang 210 SGK Hóa 11:
– Do axit no, mạch hở, đơn chức nên gọi công thức phân tử của X là CnH2n+1COOH (n ≥ 1)
– Theo bài ra, ta có: C% = 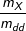 .100% ⇒ mX = (C%.mdd)/100% =
.100% ⇒ mX = (C%.mdd)/100% =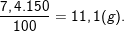
– Cũng theo bài ra, nNaOH = CM (NaOH).V = 1,5.0,1 = 0,15 (mol).
– Phương trình phản ứng:
CnH2n+1COOH + NaOH → CnH2n+1COONa + H2O
– Theo PTPƯ: nCnH2n+1COOH = nNaOH = 0,15 (mol).
⇒ 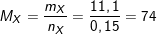
⇒ 14n + 46 = 74
⇒ n=2 ⇒ X: C2H5COOH (axit propanoic)
Bài 6 trang 210 SGK Hóa 11: Trung hòa 16,60gam hỗn hợp gồm axit axetic và axit fomic bằng dung dịch natri hiđroxit thu được 23,20 gam hỗn hợp hai muối.
a. Viết phương trình hóa học của các phản ứng ở dạng phân tử và ion rút gọn.
b. Xác định thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp trước và sau phản ứng.
* Lời giải bài 6 trang 210 SGK Hóa 11:
a) Gọi số mol của axit axetic CH3COOH và axit fomic HCOOH lần lượt là x và y (mol).
– Phương trình phản ứng dạng phân tử:
CH3COOH + NaOH → CH3COONa + H2O
x mol x mol
HCOOH + NaOH → HCOONa + H2O
y mol y mol
– Phương trình phản ứng dạng ion rút gọn:
CH3COOH + OH– → CH3COO– + H2O
HCOOH + OH– → HCOO– + H2O
b) Theo đề bài ta có hệ phương trình:
– 
– Giải hệ ta được x = 0,2 (mol), y = 0,1 (mol).
⇒ mCH3COOH = 0,2.60 = 12 (g).
⇒ %mCH3COOH =  % = 72,3%
% = 72,3%
⇒ %mHCOOH = 100% – 72,3% = 27,7%
– Có: mCH3COONa = 0,2.82 = 16,4 (g)
⇒ %mCH3COONa =  % = 70,7%
% = 70,7%
⇒ %mHCOONa = 100% – 70,7% = 29,3%.
Bài 7 trang 210 SGK Hóa 11: Đun 12,0 gam axit axetic với một lượng dư ancol etylic ( có axit H2SO4 đặc làm xúc tác ). Đến khi dừng thí nghiệm thu được 12,3 gam este.
a. Viết phương trình hóa học của phản ứng.
b. Tính phần trăm khối lượng của axit đã tham gia phản ứng este hóa.
* Lời giải bài 7 trang 210 SGK Hóa 11:
a) Phương trình hóa học:
CH3COOH + C2H5OH ![small xrightarrow[]{H_{2}SO_{4}}](https://tmdl.edu.vn/wp-content/uploads/2023/03/1552461483xjztpq70i4.gif) CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
b) Theo bài ra, ta có: nCH3COOH = 12/60 = 0,2 (mol).
nCH3COOC2H5 = 12,3/88 = 0,14 (mol).
– Theo PTPƯ: thì 1 mol CH3COOH tạo ra 1 mol CH3COOC2H5
– Nên ta có tỉ lệ: 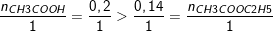
⇒ CH3COOH dư
⇒ nCH3COOH (tham gia pư) = nCH3COOC2H5 = 0,14 (mol).
⇒ %maxit este hoá =  % = 70%.
% = 70%.
Hy vọng với bài viết về tính chất hoá học, công thức cấu tạo của Axit cacboxylic và bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-11-bai-45/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




