Hoá 11 bài 7: Tính chất hoá học, cấu tạo phân tử của Nitơ N2. Nitơ N2 là chất khí, không màu, không mùi, không vị và được ứng dụng khá nhiều trong đời sống để sản xuất phân đạm, axit nitric và đặc biệt là công nghiệp luyện kim và bảo quản mẫu phẩm sinh học,…
Vậy Nitơ N2 có tính chất hoá học và tính chất vật lý đặc trưng nào? cấu tạo phân tử ra sao? Nitơ được điều chế như thế nào và có ứng dụng gì trong đời sống, chúng ta hãy cùng tìm hiểu qua bài viết cụ thể dưới đây.
Bạn đang xem bài: Hoá 11 bài 7: Tính chất hoá học, cấu tạo phân tử của Nitơ N2
I. Cấu tạo phân tử và tính chất vật lý của Nitơ N2
1. Cấu tạo phân tử của Nitơ
a) Sơ lược về Nitơ trong bảng HTTH.
– Ký hiệu của Nitơ: N thuộc ô thứ 7 nhóm VA
– Cấu hình electron: 1s22s22p3
– Khối lượng nguyên tử: 14
– Khối lượng phân tử: 28
b) Cấu tạo phân tử của Nitơ
– Phân tử Nitơ gồm 2 nguyên tử, giữa chúng hình thành 1 liên kết 3: (N≡N) 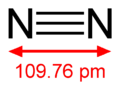
– Trong các hợp chất, các nguyên tố nhóm nitơ có mức oxi hóa cao nhất là +5, ngoài ra còn có các mức -3 và +3. Riêng N còn có thêm các mức oxi hóa +1, +2 và +4.
2. Tính chất vật lý của Nitơ
– Chất khí, không màu, không mùi, không vị, không duy trì sự sống, sự cháy.
II. Tính chất hoá học của Nitơ
– Các mức oxi hóa mà Nitơ (N) có thể có là: -3, 0, +1, +2, +3, +4, +5.
– Vì phân tử chứa liên kết ba rất bền vững nên ở điều kiện thường, nitơ là một chất ít hoạt động chỉ tham gia phản ứng ở nhiệt độ cao. Nitơ vừa là chất khử vừa là chất oxi hóa.
1. Nitơ là chất oxi hóa
a) Nitơ tác dụng với kim loại → Muối Nitrua.
– PTPƯ: N2 + Kim loại → Muối Nitrua
+ Nhiệt độ thường chỉ tác dụng với Li:
6Li + N2 → 2Li3N
+ Nhiệt độ cao phản ứng với một số kim loại như Mg, Ca và Al,…
2Al + N2 → 2AlN
3Ca + N2 → Ca3N2
b) Nitơ tác dụng với H2 → Amoniac
N2 + 3H2 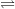 2NH3
2NH3
– Phản ứng này xảy ra trong điều kiện nhiệt độ > 4000C; áp suất p và xúc tác Fe.
2. Nitơ là chất khử (N2 + O2)
– Phản ứng của Nitơ với Oxi xảy ra ở nhiệt độ 30000C hoặc trong lò hồ quang điện
N2 + O2 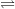 2NO
2NO
– Khí NO không màu hoá nâu trong không khí do phản ứng:
2NO không màu + O2 → 2NO2 (màu nâu đỏ)
3. Điều chế nitơ
– Trong phòng thí nghiệm: nhiệt phân muối amoni nitrit
NH4NO2 ![small xrightarrow[]{t^{0}} 1553767618me3b447lcb](https://tmdl.edu.vn/wp-content/uploads/2023/03/1553767618me3b447lcb.gif) N2 + 2H2O
N2 + 2H2O
NH4Cl + NaNO2 ![small xrightarrow[]{t^{0}} 1553767618me3b447lcb](https://tmdl.edu.vn/wp-content/uploads/2023/03/1553767618me3b447lcb.gif) N2 + NaCl + 2H2O
N2 + NaCl + 2H2O
– Trong công nghiệp: chưng cất phân đoạn không khí lỏng, dùng màng lọc rây phân tử.
4. Cách nhận biết Nitơ
– Trong các bài toán nhận biết, N2 thường được để lại để nhận biết sau cùng.
5. Ứng dụng của Nitơ
– Trong tự nhiên, nitơ tồn tại ở dạng tự do và trong hợp chất:
+ Dạng tự do: Nitơ chiếm 80% thể tích không khí.
+ Dạng hợp chất: có nhiều ở dạng NaNO3 (diêm tiêu natri), trong thành phần protein, axit nucleic…
– Nitơ được ứng dụng phần lớn được dùng để tổng hợp amoniac từ đó sản xuất ra các loại phân đạm, axit nitric,..
– Nitơ còn được dùng làm môi trường trơ cho các ngành công nghiệp luyện kim; nitơ lỏng được dùng để bảo quản máu và các các mẫu sinh học khác,…
II. Bài tập về Nitơ
Bài 3 trang 31 SGK hóa 11: a) Tìm các cặp công thức đúng của liti nitrua và nhóm nitrua:
A. LiN3 và Al3N
B. Li3N và AlN
C. Li2N3 và Al2N3
D. Li3N2 và Al3N2
b) Viết phương trình hoá học của phản ứng tạo thành liti nitrua và nhóm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hoá hay chất khử?
* Lời giải bài 3 trang 31 SGK hóa 11:
a) Đáp án: B. Li3N và AlN
– Khi liên kết với kim loại nitơ dễ nhận thêm 3e (N có 5e lớp ngoài cùng nên có số oxi hoá -3 còn Li dễ nhường 1e và Al dễ nhường 3e nên lần lượt có số oxi hoá là +1 và +3)
b) Phương trình hoá học của phản ứng
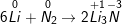

– Ta thấy trong các phản ứng trên nitơ là chất oxi hoá vì 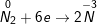
Bài 4 trang 31 SGK hóa 11: Nguyên tố nitơ có số oxi hoá là bao nhiêu trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2?
* Lời giải bài 4 trang 31 SGK hóa 11:
– Trong các hợp chất: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2
– Số oxi hoá của nitơ lần lượt là: +2, +4, -3, -3, +1, +3, +5, -3.
Bài 5 trang 31 SGK hóa 11: Cần bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lít khí amoniac? Biết rằng thể tích của các khí đề được đo ở cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%?
* Lời giải bài 5 trang 31 SGK hóa 11:
– Ở cùng điều kiện nhiệt độ áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol.
– Ta có phương trình phản ứng:
N2 + 3H2 ![small xrightarrow[]{t^{0},p,xt}](https://tmdl.edu.vn/wp-content/uploads/2023/03/1553769339ccl6q6lxdt.gif) 2NH3
2NH3
? lít ? lít ← 67,2 (lít)
– Theo PTPƯ, ta có:
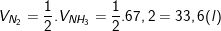
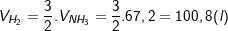
– Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:


– Kết luận: Vậy thể tích Nitơ cần lấy là 134,4 lít còn Hidro là 403,2 lít.
Hy vọng với bài viết về tính chất hoá học, cấu tạo phân từ của Nitơ và bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để các thầy cô ghi nhận và hỗ trợ, chúc các em học tập tốt.
Xem thêm Hoá 11 bài 7
Hoá 11 bài 7: Tính chất hoá học, cấu tạo phân tử của Nitơ N2. Nitơ N2 là chất khí, không màu, không mùi, không vị và được ứng dụng khá nhiều trong đời sống để sản xuất phân đạm, axit nitric và đặc biệt là công nghiệp luyện kim và bảo quản mẫu phẩm sinh học,… Vậy Nitơ N2 có tính chất hoá học và tính chất vật lý đặc trưng nào? cấu tạo phân tử ra sao? Nitơ được điều chế như thế nào và có ứng dụng gì trong đời sống, chúng ta hãy cùng tìm hiểu qua bài viết cụ thể dưới đây. I. Cấu tạo phân tử và tính chất vật lý của Nitơ N2 1. Cấu tạo phân tử của Nitơ a) Sơ lược về Nitơ trong bảng HTTH. – Ký hiệu của Nitơ: N thuộc ô thứ 7 nhóm VA – Cấu hình electron: 1s22s22p3 – Khối lượng nguyên tử: 14 – Khối lượng phân tử: 28 b) Cấu tạo phân tử của Nitơ – Phân tử Nitơ gồm 2 nguyên tử, giữa chúng hình thành 1 liên kết 3: (N≡N) cấu tạo phân tử nitơ – Trong các hợp chất, các nguyên tố nhóm nitơ có mức oxi hóa cao nhất là +5, ngoài ra còn có các mức -3 và +3. Riêng N còn có thêm các mức oxi hóa +1, +2 và +4. 2. Tính chất vật lý của Nitơ – Chất khí, không màu, không mùi, không vị, không duy trì sự sống, sự cháy. II. Tính chất hoá học của Nitơ – Các mức oxi hóa mà Nitơ (N) có thể có là: -3, 0, +1, +2, +3, +4, +5. – Vì phân tử chứa liên kết ba rất bền vững nên ở điều kiện thường, nitơ là một chất ít hoạt động chỉ tham gia phản ứng ở nhiệt độ cao. Nitơ vừa là chất khử vừa là chất oxi hóa. 1. Nitơ là chất oxi hóa a) Nitơ tác dụng với kim loại → Muối Nitrua. – PTPƯ: N2 + Kim loại → Muối Nitrua + Nhiệt độ thường chỉ tác dụng với Li: 6Li + N2 → 2Li3N + Nhiệt độ cao phản ứng với một số kim loại như Mg, Ca và Al,… 2Al + N2 → 2AlN 3Ca + N2 → Ca3N2 b) Nitơ tác dụng với H2 → Amoniac N2 + 3H2 small ightleftharpoons 2NH3 – Phản ứng này xảy ra trong điều kiện nhiệt độ > 4000C; áp suất p và xúc tác Fe. 2. Nitơ là chất khử (N2 + O2) – Phản ứng của Nitơ với Oxi xảy ra ở nhiệt độ 30000C hoặc trong lò hồ quang điện N2 + O2 small ightleftharpoons 2NO – Khí NO không màu hoá nâu trong không khí do phản ứng: 2NO không màu + O2 → 2NO2 (màu nâu đỏ) 3. Điều chế nitơ – Trong phòng thí nghiệm: nhiệt phân muối amoni nitrit NH4NO2 small xrightarrow[]{t^{0}} N2 + 2H2O NH4Cl + NaNO2 small xrightarrow[]{t^{0}} N2 + NaCl + 2H2O – Trong công nghiệp: chưng cất phân đoạn không khí lỏng, dùng màng lọc rây phân tử. 4. Cách nhận biết Nitơ – Trong các bài toán nhận biết, N2 thường được để lại để nhận biết sau cùng. 5. Ứng dụng của Nitơ – Trong tự nhiên, nitơ tồn tại ở dạng tự do và trong hợp chất: + Dạng tự do: Nitơ chiếm 80% thể tích không khí. + Dạng hợp chất: có nhiều ở dạng NaNO3 (diêm tiêu natri), trong thành phần protein, axit nucleic… – Nitơ được ứng dụng phần lớn được dùng để tổng hợp amoniac từ đó sản xuất ra các loại phân đạm, axit nitric,.. – Nitơ còn được dùng làm môi trường trơ cho các ngành công nghiệp luyện kim; nitơ lỏng được dùng để bảo quản máu và các các mẫu sinh học khác,… II. Bài tập về Nitơ Bài 3 trang 31 SGK hóa 11: a) Tìm các cặp công thức đúng của liti nitrua và nhóm nitrua: A. LiN3 và Al3N B. Li3N và AlN C. Li2N3 và Al2N3 D. Li3N2 và Al3N2 b) Viết phương trình hoá học của phản ứng tạo thành liti nitrua và nhóm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hoá hay chất khử? * Lời giải bài 3 trang 31 SGK hóa 11: a) Đáp án: B. Li3N và AlN – Khi liên kết với kim loại nitơ dễ nhận thêm 3e (N có 5e lớp ngoài cùng nên có số oxi hoá -3 còn Li dễ nhường 1e và Al dễ nhường 3e nên lần lượt có số oxi hoá là +1 và +3) b) Phương trình hoá học của phản ứng small 6overset{0}{Li}+overset{0}{N_{2}} ightarrow 2overset{+1}{Li_{3}}overset{-3}{N} small 2overset{0}{Al}+overset{0}{N_{2}} ightarrow 2overset{+3}{Al}overset{-3}{N} – Ta thấy trong các phản ứng trên nitơ là chất oxi hoá vì small overset{0}{N_{2}}+6e ightarrow 2overset{-3}{N} Bài 4 trang 31 SGK hóa 11: Nguyên tố nitơ có số oxi hoá là bao nhiêu trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2? * Lời giải bài 4 trang 31 SGK hóa 11: – Trong các hợp chất: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2 – Số oxi hoá của nitơ lần lượt là: +2, +4, -3, -3, +1, +3, +5, -3. Bài 5 trang 31 SGK hóa 11: Cần bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lít khí amoniac? Biết rằng thể tích của các khí đề được đo ở cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%? * Lời giải bài 5 trang 31 SGK hóa 11: – Ở cùng điều kiện nhiệt độ áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol. – Ta có phương trình phản ứng: N2 + 3H2 small xrightarrow[]{t^{0},p,xt} 2NH3 ? lít ? lít ← 67,2 (lít) – Theo PTPƯ, ta có: small V_{N_{2}}=frac{1}{2}.V_{NH_{3}}=frac{1}{2}.67,2=33,6(l) small V_{H_{2}}=frac{3}{2}.V_{NH_{3}}=frac{3}{2}.67,2=100,8(l) – Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là: small V_{N_{2}}=33,6.frac{100}{25}=134,4(li’t) small small V_{H_{2}}=100,8.frac{100}{25}=403,2(li’t) – Kết luận: Vậy thể tích Nitơ cần lấy là 134,4 lít còn Hidro là 403,2 lít. Hy vọng với bài viết về tính chất hoá học, cấu tạo phân từ của Nitơ và bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để các thầy cô ghi nhận và hỗ trợ, chúc các em học tập tốt. Đăng bởi: Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-11-bai-7-tinh-chat-hoa-hoc-cau-tao-phan-tu-cua-nito-n2/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





