Hoá 12 bài 26: Tính chất hoá học của kim loại Kiềm thổ, hợp chấp của kiềm thổ và bài tập vận dụng. Kiềm thổ là kim loại có tính chất hoá học và vật lý gần giống với kim loại kiềm vì vậy mà rất nhiều bạn học sinh dễ bị nhầm lẫn giữa 2 nhóm kim loại này.
Trong bài viết này chúng ta cùng tìm hiểu kim loại kiềm thổ là gì? kiềm thổ có tính chất hoá học và vật lý nào đặc trưng và nó khác gì so với kim loại kiềm chúng ta đã tìm hiểu ở bài trước.
Bạn đang xem bài: Hoá 12 bài 26: Tính chất hoá học của kim loại Kiềm thổ, hợp chấp của kiềm thổ và bài tập vận dụng
I. Vị trí cấu tạo của kim loại kiềm thổ
– Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn; trong một chu kì, kiềm thổ đứng sau kim loại kiềm.
– Kim loại kiềm thổ gồm: Beri (Be); Magie (Mg); Canxi (Ca); Stronti ( Sr); Bari (Ba); Rađi (Ra) (Rađi là nguyên tố phóng xạ không bền).
– Cấu hình electron lớp ngoài cùng là: ns2 (với n là thứ tự lớp)
II. Tính chất vật lý của kim loại kiềm thổ
– Màu sắc : kim loại kiềm thổ có màu trắng bạc hoặc xám nhạt, có thể rát mỏng.
– Nhiệt độ nóng chảy và nhiệt độ sôi tuy có cao hơn kim loại kiềm nhưng vẫn tương đối thấp
– Khối lượng riêng tương đối nhỏ, nhẹ hơn nhôm trừ Bari
– Độ cứng cao hơn kim loại kiềm nhưng vẫn tương đối mềm
III. Tính chất hoá học của kim loại kiềm thổ
– Các kim loại kiềm thổ có tính khử mạnh, yếu hơn so với kim loại kiềm. Tính khử của các kim loại kiềm thổ tăng từ Be → Ba.
M – 2e → M2+
1. Kim loại kiềm thổ tác dụng với phi kim
– Khi đốt nóng trong không khí, các kim loại kiềm thổ đều bốc cháy tạo oxit, phản ứng phát ra nhiều nhiệt.
2Mg + O2 → 2MgO
– Trong không khí ẩm Ca, Sr, Ba tạo nên lớp cacbonat (phản ứng với không khí như oxi) cho nên cần cất giữ các kim loại này trong bình rất kín hoặc dầu hỏa khan.
– Khi đun nóng, tất cả các kim loại kiềm thổ tương tác mãnh liệt với halogen, nitơ, lưu huỳnh, photpho, cacbon, siliC.
Ca + Cl2 → CaCl2
2Mg + Si → Mg2Si
– Do có ái lực lớn hơn oxi, khi đun nóng các kim loại kiềm thổ khử được nhiều oxit bền (B2O3, CO2, SiO2, TiO2, Al2O3, Cr2O3,).
2Be + TiO2 → 2BeO + Ti
2Mg + CO2 → 2MgO + C
2. Kim loại kiềm thổ tác dụng với axit
a) HCl, H2SO4 (loãng) : Kim loại kiềm khử ion H+ thành H2
Mg + 2H+ → Mg2+ + H2↑
b) HNO3, H2SO4 đặc : Khử N+5, S+6 thành các hợp chất có mức oxi hoá thấp hơn.
4Ca + 10HNO3 (loãng) → 4Ca(NO3)2 + NH4NO3 + 3H2O
Mg + 4HNO3 đặc → Mg(NO3)2 + 2NO2↑ + 2H2O
4Mg + 5H2SO4 đặc → 4MgSO4 + H2S↑ + 4H2O
3. Kim loại kiềm thổ tác dụng với nước
– Ca, Sr, Ba tác dụng với nước ở nhiệt độ thường tạo dung dịch bazơ:
Ca + 2H2O → Ca(OH)2 + H2↑
– Mg không tan trong nước lạnh, tan chậm trong nước nóng tạo thành MgO.
Mg + H2O → MgO + H2↑
– Be không tan trong nước dù ở nhiệt độ cao vì có lớp oxit bền bảo vệ. Nhưng Be có thể tan trong dung dịch kiềm mạnh hoặc kiềm nóng chảy tạo berilat:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2↑
Be + 2NaOH(nóng chảy) → Na2BeO2 + H2↑
IV. Ứng dụng và điều chế kim loại kiềm thổ
1. Ứng dụng của kim loại kiềm thổ
– Kim loại Be: làm chất phụ gia để chế tạo hợp kim có tính đàn hồi cao, bền, chắc, không bị ăn mòn.
– Kim loại Ca: dùng làm chất khử để tách oxi, lưu huỳnh ra khỏi thép, làm khô 1 số hợp chất hữu cơ.
– Kim loại Mg có nhiều ứng dụng hơn cả: tạo hợp kim có tính cứng, nhẹ, bền để chế tạo máy bay, tên lửa, ôtô… Mg còn được dùng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm dùng trong pháo sáng, máy ảnh.
2. Điều chế kim loại kiềm thổ
– Trong tự nhiên, kim loại kiềm thổ chỉ tồn tại dạng ion M2+ trong các hợp chất.
– Phương pháp cơ bản là điện phân muối nóng chảy của chúng.
CaCl2 ![small xrightarrow[]{dpnc}](https://tmdl.edu.vn/wp-content/uploads/2022/12/giflatexsmallspacexrightarrowd_1550129616.gif) Ca + Cl2↑
Ca + Cl2↑
MgCl2 ![small xrightarrow[]{dpnc}](https://tmdl.edu.vn/wp-content/uploads/2022/12/giflatexsmallspacexrightarrowd_1550129616.gif) Mg + Cl2↑
Mg + Cl2↑
– Một số phương pháp khác:
+ Dùng than cốc khử MgO; CaO từ đolomit bằng febositic (hợp chất Si và Fe) ở nhiệt độ cao và trong chân không.
MgO + C → Mg + CO
CaO + 2MgO + Si → 2Mg + CaO.SiO2
+ Dùng nhôm hay magie khử muối của Ca, Sr, Ba trong chân không ở 11000C → 12000C.
2Al + 4CaO → CaO.Al2O3 + 3Ca
2Al + 4SrO → SrO. Al2O3 + 3Sr
2Al + 4BaO → BaO. Al2O3 + 3Ba
V. Một số hợp chất quan trọng Canxi – kim loại kiềm thổ
1. Canxi oxit: CaO (Vôi sống)
– Tác dụng với nước, tỏa nhiệt : CaO + H2O → Ca(OH)2 ít tan.
– Với axit : CaO + 2HCl → CaCl2 + H2O
– Với oxit axit : CaO + CO2 → CaCO3 ( vôi chết )
2. Các hiđroxit M(OH)2 của các kim loại kiềm thổ
a) Tính chất của các hidroxit
– Các hiđroxit M(OH)2 khan đều ở dạng màu trắng.
– Tính tan: Be(OH)2; Mg(OH)2 rất ít tan trong nướC.
Ca(OH)2 tương đối ít tan ( 0,12g/100g H2O).
Các hiđroxit còn lại tan nhiều trong nướC.
– Độ bền nhiệt của hiđroxit tăng từ Be → Ba: Mg(OH)2 mất nước ở 150◦C; Ba(OH)2 mất nước ở 1000◦C tạo thành oxit.
– Tính bazơ: Be(OH)2 là bazơ rất yếu, Mg(OH)2 là bazơ trung bình, Ca(OH)2; Ba(OH)2; Sr(OH)2 là bazơ mạnh.
b) Canxi hidroxit : Ca(OH)2 (Vôi tôi)
– Ít tan trong nước : Ca(OH)2 → Ca2+ + 2OH–
– Với axít : Ca(OH)2 + 2HCl → CaCl2 + H2O
– Với oxit axit : Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + CO2 → Ca(HCO3)2
– Với d2 muối : Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
c) Ứng dụng của các hidroxit
– Hợp chất hidroxit kim loại kiềm thổ Ca(OH)2 ứng dụng rộng rãi hơn cả :trộn vữa xây nhà, khử chua đất trồng, sản xuất cloruavôi dùng để tẩy trắng và khử trùng.
3. Canxi cacbonat (CaCO3) và Canxi hidro cacbonat Ca(HCO3)2
|
CaCO3 : Canxi cacbonat |
Ca(HCO3)2 : Canxi hidro cacbonat |
|
|
Với nước |
Canxi cacbonat là chất rắn màu trắng, không tan trong nước. nhưng tan trong amoniclorua: CaCO3 + 2NH4Cl → CaCl2 + 2NH3↑ + CO2↑ + H2O |
Tan trong nước: Ca(HCO3)2 → Ca2+ + 2HCO3– |
|
Với bazơ mạnh |
Không phản ứng |
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O |
|
Với axit mạnh |
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O |
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2↑ + 2H2O lưỡng tính |
|
Nhiệt phân |
Bị phân hủy ở nhiệt độ cao: CaCO3 –t0→ CaO + CO2↑ |
Bị phân hủy khi đun nóng nhẹ: Ca(HCO3)2 –t0→ CaCO3 + CO2↑ + H2O |
|
Phản ứng trao đổi với CO2 , PO43- |
Không |
Ca(OH)2 + CO2 → CaCO3↓ + H2O 3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2↓ + 6H2O |
|
Với CO2 |
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2 không tan tan Chiều thuận (1): Giải thích sự xâm thực của nước mưa đối với đá vôi tạo hang động. Chiều nghịch (2): Giải thích sự tạo thành thạch nhũ trong hang động. |
|
4. Canxi sunfat (CaSO4)
a) Tính chất của canxi sunfat
– Là chất rắn màu trắng tan ít trong nước (ở 25◦C tan 0,15g/100g H2O).
– Tùy theo lượng nước kết tinh trong muối sunfat, ta có 3 loại:
+ CaSO4.2H2O : thạch cao sống trong tự nhiên, bền ở nhiệt độ thường.
+ CaSO4.H2O hoặc CaSO4.0,5H2O : thạch cao nung (hemihiđrat)
+ CaSO4.2H2O → CaSO4.0,5H2O + 1,5H2O (125◦C)
– Đun nóng 200◦C; thạch cao nung thành thạch cao khan (CaSO4).
CaSO4.0,5H2O ![small xrightarrow[]{200^{0}C}](https://tmdl.edu.vn/wp-content/uploads/2022/12/giflatexsmallspacexrightarrow200_1550129619.gif) CaSO4 + ½H2O
CaSO4 + ½H2O
– CaSO4: không tan trong nước, không tác dụng với nước, chỉ phân hủy ở nhiệt độ rất cao.
2CaSO4 ![small xrightarrow[]{960^{0}C}](https://tmdl.edu.vn/wp-content/uploads/2022/12/giflatexsmallspacexrightarrow960_1550129621.gif) 2CaO + 2SO2 + O2
2CaO + 2SO2 + O2
b) Ứng dụng của canxi sunfat
– Thạch cao nung có thể kết hợp với nước tao thành thạch cao sống và khi đông cứng thì giãn nở thể tích, do vậy thạch cao rất ăn khuôn. Thạch cao nung thường được đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thất, làm phấn viết bảng, bó bột khi gãy xương,…
– Thạch cao sống dùng để sản xuất xi măng.
5. Nước cứng
a) Khái niệm Nước cứng
– Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. Nước chứa ít hoặc không chứa các ion trên được gọi là nước mềm.
b) Phân loại nước cứng
– Căn cứ vào thành phần các anion gốc axit có trong nước cứng, người ta chia nước cứng ra 3 loại:
* Nước cứng tạm thời: Tính cứng tạm thời của nước cứng là do các muối Ca(HCO3)2, Mg(HCO3)2 gây ra:
Ca(HCO3)2 → Ca2+ + 2HCO3–
– Goị là tạm thời vì độ cứng sẽ mất đi khi đun sôi: M(HCO3)2 →MCO3 + CO2 + H2O
* Nước cứng vĩnh cửu: Tính cứng vĩnh cửu của nước là do các muối CaCl2, MgCl2, CaSO4, MgSO4 gây ra, gọi là vĩnh cữu vì khi đun nóng muối đó sẽ không phân hủy:
* Nước có tính cứng toàn phần: Là nước có cả tính cứng tạm thời và vĩnh cửu.
– Nước tự nhiên thường có cả tính cứng tạm thời và vĩnh cửu.
c) Tác hại của nước cứng
* Về mặt đời sống thường ngày:
– Giặt áo quần bằng xà phòng (natri stearat C17H35COONa) trong nước cứng sẽ tạo ra muối không tan là canxi stearat (C17H35COO)2Ca, chất này bán trên vải sợi, làm cho quần áo mau mục nát.
2C17H35COONa +MCl2 →(C17H35COO)2M$ +2NaCl
– Nước cứng làm cho xà phòng có ít bọt, giảm khả năng tẩy rửA.
– Nếu dùng nước cứng để nấu thức ăn, sẽ làm cho thực phẩm lâu chín và giảm mùi vị do phản ứng của các ion và các chất trong thực phẩm.
* Về mặt sản xuất công nghiệp:
– Khi đun nóng,ở đáy nồi hay ống dẫn nước nóng sẽ gây ra lớp cặn đá kém dẫn nhiệt làm hao tổn chất đốt, gây nổ nồi hơi và tắc nghẽn ống dẫn nước nóng (không an toàn).
– Làm hỏng nhiều dung dịch cần pha chế.
– Vì vậy, việc làm mềm nước cứng trước khi dùng có y nghĩa rất quan trọng.
d) Các phương pháp làm mềm nước cứng
– Nguyên tắc làm mềm nước cứng là giảm nồng độ các cation Ca2+,Mg2+ trong nước cứng.
* Phương pháp kết tủa:
- Đối với nước có tính cứng tạm thời
– Đun sôi nước có tính cứng tạm thời trước khi dùng, muối hiđrocacbonat chuyển thành muối cacbonat không tan:
Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
Mg(HCO3)2 → MgCO3↓ + CO2↑ + H2O
⇒ Lọc bỏ kết tủa được nước mềm.
– Dùng một khối lượng vừa đủ dung dịch Ca(OH)2, Na2CO3 để trung hòa muối hiđrocacbonat thành muối cacbonat kết tủA. Lọc bỏ chất không tan, được nước mềm:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2 + 2CaCO3 + 2H2O
M(HCO3)2 + Na2CO3 → MCO3 + 2NaHCO3
- Đối với nước có tính cứng vĩnh cửu:
– Dùng dung dịch Na2CO3, Ca(OH)2 và dung dịch Na3PO4 để làm mềm nước cứng:
Ca2+ + CO32- → CaCO3↓
3Ca2+ + 2PO43- → Ca3(PO4)2↓
Mg2+ + CO32- + Ca2+ + 2OH– → Mg(OH)2↓ + CaCO3↓
* Phương pháp trao đổi ion:
– Phương pháp trao đổi ion được dùng phổ biến để làm mềm nướC. Phương pháp này dựa trên khả năng trao đổi ion của các hạt zeolit (các alumino silicat kết tinh, có trong tự nhiên hoặc được tổng hợp, trong tinh thể có chứa những lỗ trống nhỏ) hoặc nhựa trao đổi ion.
– Thí dụ: Cho nước cứng đi qua chất trao đổi ion là các hạt zeolit thì số mol ion Na+ của zeolit rời khỏi mạng tinh thể, đi vào trong nước nhường chỗ cho các ion Ca2+ và Mg2+ bị giữ lại trong mạng tinh thể silicat.
VI. Bài tập về Kim loại kiềm thổ
Bài 2 trang 119 SGK Hóa 12: Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. Có kết tủa trắng.
B. Có bọt khí thoát ra.
C. Có kết tủa trắng và bọt khí.
D. Không có hiện tượng gì.
* Lời giải bài 2 trang 119 SGK Hóa 12:
- Đáp án: A.Có kết tủa trắng.
– PTPƯ: Ca(OH)2 + Ca(HCO3)2 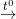 2CaCO3 + H2O
2CaCO3 + H2O
Bài 3 trang 119 SGK Hóa 12: Cho 2,84 g hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của hai muối (CaCO3 , MgCO3) trong hỗn hợp là :
A. 35,2 % và 64,8%.
B. 70,4% và 29,6%.
C. 85,49% và 14,51%.
D. 17,6% và 82,4%.
* Lời giải bài 3 trang 119 SGK Hóa 12:
- Đáp án: B.70,4% và 29,6%.
– Gọi x, y lần lượt là số mol của CaCO3 và MgCO3 trong hỗn hợp
ta có: 100x + 84y = 2,84 (1)
– Phương trình hoá học của phản ứng:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
x (mol) x
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
y (mol) y
– Theo bài ra, Số mol CO2: nCO2 = 0,672/22,4 = 0,03 (mol)
– Theo PTPƯ: nCO2 = x + y = 0,3 (2)
– Giải hệ PT (1) và (2) ta được, x = 0,02 (mol) và y = 0,01 (mol)
⇒ %mCaCO3 = [(0,02.100)/2,84].100% = 70,42%
⇒ %mMgCO3 = 100% – 70,42% = 29,58%
Bài 4 trang 119 SGK Hóa 12: Cho 2g kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be. B. Mg. C. Ca. D. Ba.
Lời giải bài 4 trang 119 SGK Hóa 12:
- Đáp án: C. Ca
– Gọi M là kim loại nhóm II, số mol là x, ta có: Mx = 2 (1)
– Phương trình hoá học của phản ứng:
M + 2HCl → MCl2 + H2↑
x (mol) x
– Theo PTPƯ ta có: (71+M)x = 5,55 (2)
– Giải hệ PT (1) và (2) ta được: x = 0,05 và M = 40
⇒ M là Ca
Bài 5 trang 119 SGK Hóa 12: Cho 2,8 g CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2(đktc) vào dung dịch A.
a) Tính khối lượng kết tủa thu được.
b) Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?
Lời giải bài 5 trang 119 SGK Hóa 12:
a) Theo bài ra, ta có số mol CaO là: nCaO = 2,8/56 = 0,05 (mol)
Số mol CO2 là nCO2 = 1,68/22,4 = 0,075 (mol)
– Phương trình hoá học của phản ứng:
CaO + H2O → Ca(OH)2
0,05 (mol) 0,05 (mol)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,05 0,05 0,05 (mol)
– Theo PTPƯ: nCaCO3 = nCO2 pư = nCa(OH)2 = 0,05 mol
⇒ nCO2 dư = 0,075 – 0,05 = 0,025 (mol)
– CaCO3 tạo thành 0,05 (mol) bị hòa tan 0,025 (mol)
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,025 0,025 0,025 (mol)
⇒ Số mol CaCO3 còn lại là: 0,05 – 0,025 = 0,025 (mol)
⇒ Khối lượng CaCO3 là: mCaCO3 = 0,025. 100 = 2,5 (g)
b) Khi đun nóng dung dịch A
Ca(HCO3)2  CaCO3↓ + CO2 + H2O
CaCO3↓ + CO2 + H2O
0,025 0,025 (mol)
⇒ Khối lượng kết tủa tối đa thu được là: mCaCO3 = (0,025 + 0,025).100 = 5 (g)
Bài 6 trang 119 SGK Hóa 12: Khi lấy 14,25g muối clorua của một kim loại chỉ có hóa trị II và một lượng muối nitrat của kim loại đó có số mol bằng số mol muối clorua thì thấy khác nhau 7,95g. Xác định tên kim loại
* Lời giải bài 6 trang 119 SGK Hóa 12:
– Gọi kim loại cần tìm là M, có hóa trị là II
⇒ Công thức muối clorua là MCl2, có số mol là x
Ta có PT: (M + 71)x = 14,25 (1)
⇒ Công thức muối nitrat là M(NO3)2.
Ta có PT: (M + 124)x = 14,25 + 7,95 (2)
– Giải hệ PT (1) và (2) ta được, x = 0,15, M = 24
⇒ M là Mg
Bài 7 trang 119 SGK Hóa 12: Hòa tan 8,2 gam hỗn hợp bột CaCO3 và MgCO3 trong nước cần 2,016 lít CO2 (đktc). Xác định số gam mỗi muối trong hỗn hợp.
* Lời giải bài 7 trang 119 SGK Hóa 12:
– Gọi x, y lần lượt là số mol CaCO3 và MgCO3 trong hỗn hợp
⇒ 100x + 84y = 8,2 (1)
– Theo bài ra, ta có: nCO2 = 2,016/22,4=0,09 (mol)
– Phương trình hoá học của phản ứng:
CaCO3 + CO2 + H2O → Ca(HCO3)2
x x (mol)
MgCO3 + CO2 + H2O → Mg(HCO3)2
y y (mol)
– Theo PTPƯ: nCO2 = x + y = 0,09 (2)
– Giải hệ PT gồm (1) và (2) ta được, x = 0,04 và y = 0,05
⇒ mCaCO3 = 0,04.100 = 4 (g)
⇒ mMgCO3 = 0,05.84 = 4,2 (g)
Bài 8 trang 119 SGK Hóa 12: Trong một cốc nước có chứa 0,01 mol Na+ , 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3–, 0,02 mol Cl–. Nước trong cốc thuộc loại nào ?
A. Nước cứng có tính cứng tạm thời.
B. Nước cứng có tính cứng vĩnh cửu.
C. Nước cứng có tính cứng toàn phần.
* Lời giải bài 8 trang 119 SGK Hóa 12:
- Đáp án: C. Nước cứng có tính cứng toàn phần.
– Cốc nước trên chứa các ion: Ca2+, Mg2+, HCO3–, Cl–
⇒ Thuộc nước cứng toàn phần (có cả tính cứng tạm thời và tính cứng vĩnh cửu)
Bài 9 trang 119 SGK Hóa 12: Viết phương trình hóa học của phản ứng để giải thích việc dùng Na3PO4 để làm mềm nước cứng có tính cứng toàn phần.
* Lời giải bài 9 trang 119 SGK Hóa 12:
– Các phương trình hoá học của phản ứng
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3Mg(HCO3)2 + 2Na3PO4 → Mg3(PO4)2↓ + 6NaHCO3
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
3CaSO4 +2Na3PO4 → Ca3(PO4)2↓ + 3Na2SO4.
– Khi đó tất cả các ion Ca2+, Mg2+ đều kết tủa hết dưới dạng muối photphat => làm mềm được nước cứng toàn phần.
Hy vọng với bài viết hệ thống lại kiến thức về tính chất hoá học của kim loại kiềm thổ, các hợp chất quan trọng của kim loại kiềm thổ và bài tập vận dụng ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại bình luận dưới bài viết để được hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Tmdl.edu.vn (tmdl.edu.vn)
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục