Hoá 12 bài 27: Tính chất hoá học của nhôm Al, hợp chất nhôm oxit, nhôm hidroxit. Nhôm Al và các hợp chất của nhôm như nhôm oxit Al2O3 nhôm hidroxit Al(OH)3 hay nhôm sunfat Al2(SO4)3 có nhiều ứng dụng trong thực tế do nó có tính chất vật lý và tính chất hoá học đặc trưng và riêng biệt.
Vậy nhôm và các hợp chất của nhôm là nhôm oxit, nhôm hidroxit và nhôm sunfat có những tính chất hoá học và tính chất vật lý nào đặc trưng, được điều chế và ứng dụng vào các lĩnh vực nào trong đời sống mà lại có vai trò quan trọng như vậy, chúng ta hãy cùng tìm hiểu qua bài viết dưới đây.
Bạn đang xem bài: Hoá 12 bài 27: Tính chất hoá học của nhôm Al, hợp chất nhôm oxit, nhôm hidroxit
I. Vị trí của Nhôm AL trong bảng HTTH
– Cấu hình e nguyên tử: 13Al: 1s22s22p63s23p1
– Vị trí: Al thuộc ô 13, chu kì 3, nhóm IIIA.
II. Trạng thái tự nhiên và tính chất vật lý của Nhôm
1. Trạng thái tự nhiên của nhôm
– Nhôm là kim loại phổ biến nhất trong vỏ quả đất. Trong tự nhiên, Al có trong:
- Đất sét: Al2O3.2SiO2.2H2O.
- Mica: K2O.Al2O3.6SiO2.2H2O.
- Boxit: Al2O3.nH2O.
- Criolit: 3NaF.AlF3 hay (Na3AlF6).
2. Tính chất vật lý của nhôm
– Mạng lập phương tâm diện, dẫn điện tốt (gấp 3 lần sắt, bằng 2/3 lần đồng), dẫn nhiệt tốt (gấp 3 lần sắt); t0nc = 6600C .
– Màu trắng bạc, khá bền và dai, dễ kéo sợi và dát mỏng, nhẹ (D = 2,7 g/cm3).
– Một số hợp kim của nhôm:
- Đuyra (95% Al; 4% Cu; 1% Mg, Mn, Si): nhẹ bằng 1/3 thép, cứng gần bằng thép.
- Silumin (gần 90% Al; 10% Si): nhẹ, bền.
- Almelec (98,5% Al; còn lại là Mg, Si và Fe) dùng làm dây cáp.
- Hợp kim electron (10,5% Al; 83,3% Mg còn lại là Zn, Mn…): chỉ nặng bằng 65% Al lại bền hơn thép, chịu được sự thay đổi đột ngột của nhiệt độ trong một giới hạn lớn nên được dùng làm vỏ tên lửa.
III. Tính chất hoá học của Nhôm
– Nhôm là kim loại có tính khử mạnh, chỉ sau kim loại kiềm và kiểm thổ nên dễ bị oxi hoá thành ion dương:
Al → Al3+ + 3e
1. Nhôm tác dụng với Phi kim
a) Nhôm tác dụng với Oxi (Al + O2)
– Al chỉ phản ứng với oxi trên bề mặt (vì tạo ra lớp màng oxit bao phủ bề mặt, bảo vệ và ngăn cản Al tham gia phản ứng tiếp):
2Al + 3/2O2 → Al2O3
– Bột Al cháy trong không khí khi được đun nóng cho ngọn lửa màu sáng chói.
– Muốn phản ứng xảy ra hoàn toàn thì phải loại bỏ lớp oxit bao phủ trên bề mặt Al (bằng cách tạo hỗn hỗng Al – Hg hoặc dùng Al bột đun nóng).
b) Nhôm tác dụng với các phi kim khác
– Nhôm phản ứng được với các phi kim khác → muối.
– Al tự bốc cháy khi tiếp xúc với các halogen:
* Tổng quát: 2Al + 3X2 → 2AlX3
– Al tác dụng với Clo: Al + Cl2
2Al + 3Cl2 → 2AlCl3
– Khi đun nóng, Al tác dụng với bột S: Al + S
2Al + 3S 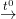 Al2S3
Al2S3
– Khi nhiệt độ rất cao (8000C), Al kết hợp với C và N2: Al + C
4Al + 3C ![small xrightarrow[]{800^{0}C} 1609384773cm19q00s6u 1](https://tmdl.edu.vn/wp-content/uploads/2022/12/1609384773cm19q00s6u-1.gif) Al4C3
Al4C3
2. Nhôm tác dụng với nước
– Al không phản ứng với nước vì được lớp oxit mỏng, bền và đặc khít bảo vệ. Nếu phá bỏ lớp oxit bao phủ bề mặt, Al phản ứng trực tiếp với nước.
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
– Al(OH)3 là chất kết tủa dạng keo màu trắng khi sinh ra sẽ bao kín bề mặt của Al kim loại ngăn cách không cho Al tiếp xúc với nước để phản ứng tiếp nữa. Phản ứng này chỉ có ý nghĩa về mặt lý thuyết.
3. Nhôm tác dụng với oxit của kim loại kém hoạt động hơn (phản ứng nhiệt nhôm)
– Al khử được oxit của các kim loại đứng sau nó:
2yAl + 3FexOy  yAl2O3 + 3xFe
yAl2O3 + 3xFe
– Al tác dụng với Fe2O3: Al + Fe2O3
2Al + Fe2O3  Al2O3 + 2Fe
Al2O3 + 2Fe
– Al tác dụng với CuO: Al + CuO
2Al + 3CuO  Al2O3 + 3Cu
Al2O3 + 3Cu
* Những lưu ý khi giải bài tập về phản ứng nhiệt nhôm:
+ Nếu hỗn hợp sau phản ứng cho tác dụng với dung dịch kiềm → H2 thì Al còn dư sau phản ứng nhiệt nhôm hoặc hiệu suất H của phản ứng < 100%
+ Nếu hỗn hợp sau phản ứng cho tác dụng với dung dịch kiềm không có khí thoát ra chứng tỏ không dư Al.
+ Khối lượng hỗn hợp trước và sau phản ứng không đổi (bảo toàn khối lượng).
+ Vận dụng bảo toàn electron.
4. Nhôm tác dụng với dung dịch axit
a) Nhôm tác dụng với dd HCl, H2SO4 loãng
– Al phản ứng dễ dàng với dd axit HCl, H2SO4 loãng → muối + H2↑
– Tác dụng với axit HCl: Al + HCl
2Al + 6HCl → 2AlCl3 + 3H2↑
– Tác dụng với axit H2SO4 : Al + H2SO4
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2↑
b) Nhôm tác dụng với các axit có tính oxi hóa mạnh: HNO3 loãng hoặc đặc, H2SO4 đậm đặc
– Nhôm tác dụng với HNO3: Al + HNO3
Al + HNO3 → Al(NO3)3 + {NO2, NO, N2O, N2, NH4NO3} + H2O
Ví dụ: Al + 4HNO3 loãng → Al(NO3)3 + NO↑ + 2H2O
Al + 6HNO3 đặc, nóng → Al(NO3)3 + 3NO2↑ + 3H2O
– Nhôm tác dụng với H2SO4: Al + H2SO4
2Al + 6H2SO4 đặc, nóng → Al2(SO4)3 + 3SO2↑ + 6H2O
* Lưu ý:
– Al thụ động với H2SO4 đặc nguội và HNO3 đặc nguội → có thể dùng thùng Al để chuyên chở axit HNO3 đặc nguội và H2SO4 đặc nguội.
– Phản ứng của Al với dung dịch HNO3 có thể tạo thành muối amoni.
5. Nhôm tác dụng với dung dịch bazơ
+ Al tham gia phản ứng dễ dàng với các dung dịch kiềm:
– Al tác dụng với NaOH: Al + NaOH
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
– Al tác dụng với Ba(OH)2 : Al + Ba(OH)2
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
* Cơ chế phản ứng:
+ Trước tiên, Al tham gia phản ứng với nước:
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
+ Al(OH)3 sinh ra là hiđroxit lưỡng tính tan được trong dung dịch kiềm:
Al(OH)3 + NaOH → NaAlO2 + 2H2O
+ Quá trình này lặp đi lặp lại đến hết.
* Đặc biệt chú ý: Nếu cho hỗn hợp Na, K, Ba, Ca và Al (hoặc Zn) vào nước dư, xảy ra các phản ứng:
2M + 2H2O → 2MOH + H2↑
MOH + H2O + Al → MAlO2 + 3⁄2H2↑
+ Trong quá trình giải toán có 2 trường hợp xảy ra:
* Trường hợp 1. Cả kim loại kiềm và Al đều phản ứng hết nếu số mol kim loại kiềm ≥ số mol Al.
* Trường hợp 2. Kim loại kiềm phản ứng hết, Al dư nếu số mol kim loại kiềm < số mol Al.
6. Nhôm tác dụng với dung dịch muối
– Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
Ví dụ: Al + CuSO4 hay Al + Cu(NO3)2
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu↓
– Phản ứng với muối nitrat trong môi trường kiềm:
8Al + 3NaNO3 + 5NaOH + 2H2O → 8NaAlO2 + 3NH3
– Phản ứng với muối nitrat trong môi trường axit (giống phản ứng với HNO3):
Al + 4H+ + NO3– → Al3+ + NO↑ + 2H2O
IV. Điều chế Nhôm
1. Nguyên liệu
Quặng boxit Al2O3 có lẫn SiO2 và Fe2O3.
2. Các giai đoạn điều chế nhôm
– Làm sạch nguyên liệu:
2NaOH + Al2O3 → 2NaAlO2 + H2O
2NaOH + SiO2 → Na2SiO3 + H2O
NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3
NaOH + CO2 → NaHCO3
2Al(OH)3 → Al2O3 + 3H2O
– Điện phân nóng chảy Al2O3 có mặt criolit Na3AlF6 (hạ nhiệt độ nóng chảy của Al2O3từ 20500C xuống 9000C; tăng độ dẫn điện do tạo thành nhiều ion hơn; tạo lớp bảo vệ không cho O2 phản ứng với Al nóng chảy):
2Al2O3 → 4Al + 3O2↑
V. Hợp chất của Nhôm
1. Nhôm Oxit Al2O3
– Chất rắn màu trắng, không tan và không tác dụng với nước, rất bền vững, nóng chảy ở 20500C.
– Tồn tại ở dạng khan (emeri, corindon, rubi (lẫn Cr2O3), saphia (lẫn TiO2 và Fe3O4) hoặc dạng ngậm nước (boxit).
a) Tính chất hóa học của nhôm oxit
– Tính bền: Al2O3 không bị khử bởi H2, CO ở nhiệt độ cao; Al2O3 tác dụng với C không cho Al kim loại mà tạo Al4C3:
Al2O3 + 9C → Al4C3 + 6CO (> 20000C)
– Nhôm là kim loại lưỡng tính:
+ Al2O3 là oxit bazơ khi tác dụng với axit mạnh → muối + H2O.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Al2O3 là oxit axit khi tác dụng với dung dịch bazơ mạnh → muối + H2O.
Al2O3 + 2NaOH → NaAlO2 + H2O
hay: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH– → 2AlO2– + H2O
b) Điều chế nhôm oxit
– Nhiệt phân Al(OH)3:
2Al(OH)3 → Al2O3 + 3H2O
2. Nhôm hiđroxit Al(OH)3
– Nhôm hiđroxit Al(OH)3 là chất kết tủa keo, màu trắng.
a) Tính chất hóa học của nhôm hidroxit
– Kém bền với nhiệt:
2Al(OH)3 → Al2O3 + 3H2O (t0)
– Là hiđroxit lưỡng tính:
+ Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
+ Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO2 + 2H2O
Al(OH)3 + KOH → K[Al(OH)4]
b) Điều chế nhôm hidroxit
– Kết tủa Al3+:
Al3+ + 3OH– (vừa đủ) → Al(OH)3↓
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
– Kết tủa AlO2–:
AlO2– + CO2 + 2H2O → Al(OH)3↓ + HCO3–
AlO2– + H+ (vừa đủ) + H2O → Al(OH)3↓
3. Muối nhôm – Nhôm Sunfat Al2(SO4)3
– Muối nhôm hay gặp: phèn chua: K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O
– Các dung dịch AlCl3, Al2(SO4)3 và Al(NO3)3 đều là các axit theo Bronstet có môi trường axit:
AlCl3 → Al3+ + 3Cl–
Al3+ + 3H2O ↔ Al(OH)3 + 3H+
⇒ Giải thích được sự thủy phân của muối Al trong các dung dịch có tính bazơ:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
– Phản ứng với dung dịch kiềm: (chú ý cách thức và tỷ lệ phản ứng)
Al3+ + 3OH– → Al(OH)3
Al3+ + 4OH– → [Al(OH)4] –
Al(OH)3 + 3OH– → [Al(OH)4] –
– Các muối aluminat NaAlO2, KAlO2, Ba(AlO2)2 và Ca(AlO2)2 đều là bazơ dung dịch có môi trường bazơ.
AlO2– + 3H2O ↔ Al(OH)3↓ + 3OH–
AlO2– + H+ + H2O → Al(OH)3↓
Al(OH)3 + 3H+ → Al3+ + 3H2O
VI. Bài tập về nhôm, hợp chất nhôm oxit, nhôm hidroxit
Bài 1 trang 128 SGK Hóa 12: Viết phương trình hóa học của các phản ứng thực hiện dãy chuyển đổi sau:
![small Alxrightarrow[]{(1)}AlCl_{3}xrightarrow[]{(2)}Al(OH_{3})xrightarrow[]{(3)}NaAlO_{2}xrightarrow[]{(4)}Al(OH)_{3}xrightarrow[]{(5)}Al_{2}O_{3}xrightarrow[]{(6)}Al 1550461857zjthfk2qig 1609384774 1](https://tmdl.edu.vn/wp-content/uploads/2022/12/1550461857zjthfk2qig_1609384774-1.gif)
* Lời giải bài 1 trang 128 SGK Hóa 12:
– Các phương trình phản ứng:
(1) 2Al + 6HCl → 2AlCl3 + 3H2↑
(2) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
(3) Al(OH)3 + NaOH → NaAlO2 + 2H2O
(4) NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3↓
(5) 2Al(OH)3 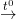 Al2O3 + 3H2O
Al2O3 + 3H2O
(6) 2Al2O3 –đpnc→ 4Al + 3O2↑
Bài 2 trang 128 SGK Hóa 12: Có hai lọ không ghi nhãn đựng dung dịch AlCl3 và dung dịch NaOH. Không dùng thêm chất nào khác, làm thế nào để nhận biết mỗi chất?
* Lời giải bài 2 trang 128 SGK Hóa 12:
– Cho hai lọ lần lượt tác dụng với nhau: Cho từ từ dd lọ 1 vào lọ 2 nếu xuất hiện kết tủa mà kết tủa tan ngay thì lọ 1 là AlCl3 và lọ 2 là NaOH
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
– Nếu cho từ từ dd lọ 1 vào lọ 2 mà có kết tủa sau một thời gian kết tủa mới tan thì lọ 1 là NaOH và lọ 2 là AlCl3
Bài 4 trang 129 SGK Hóa 12: Trong những chất sau, chất nào không có tính chất lưỡng tính ?
A. Al(OH)3. B. Al2O3.
C. ZnSO4. D. NaHCO3.
* Lời giải bài 4 trang 129 SGK Hóa 12:
- Đáp án: C. ZnSO4
– Chất lưỡng tính là chất vừa tác dụng được với dd axit vừa tác dụng được với bazơ
Bài 5 trang 129 SGK Hóa 12: Cho một lượng hỗn hợp Mg – Al tác dụng với dung dịch HCl dư thu được 8,96 lít H2. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít H2. Các thể tích khí đều đo ở đktc.
Tính khối lượng của mỗi kim loại có trong lượng hỗn hợp đã dùng.
* Lời giải bài 5 trang 129 SGK Hóa 12:
– Gọi x, y (mol) lần lượt là số mol Al và Mg trong hỗn hợp.
– Phương trình phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
x (mol) (3/2)x
Mg + 2HCl → MgCl2 + H2↑ (2)
y (mol) y
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (3)
x (mol) (3/2)x
– Khi pư với NaOH chỉ có Al phản ứng, theo bài ra và PTPƯ (3), ta có:
nH2 = (3/2)x = 6,72/22,4 = 0,3 (mol) (*)
– Theo bài ra và PTPƯ (1) và (2) thì: nH2 = (3/2)x + y = 8,96/22,4 = 0,4(mol) (**)
⇒ Từ (*) và (**) ta có: x = 0,2 và y = 0,1
⇒ mAl = 0,2.27 = 5,4 (g).
⇒ mMg = 0,1.24 = 2,4 (g).
Bài 6 trang 129 SGK Hóa 12: Cho 100 ml dung dịch AlCl3 1M tác dụng với 200ml dung dịch NaOH. Kết tủa tạo thành được làm khô và nung đến khối lượng không đổi cân nặng 2,55g. Tính nồng độ dung dịch NaOH ban đầu.
* Lời giải bài 6 trang 129 SGK Hóa 12:
– Theo bài ra, số mol AlCl3 là: nAlCl3 = 0,1.1 = 0,1 (mol).
Số mol Al2O3 là: nAl2O3 = 2,55/102 = 0,025 (mol).
* Có 2 trường hợp:
- Trường hợp 1: NaOH thiếu.
– Phương trình hoá học của phản ứng:
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl (1)
0,05.3 0,05 (mol)
2Al(OH)3 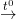 Al2O3 + 3H2O (2)
Al2O3 + 3H2O (2)
0,05 0,025 (mol)
– Theo PTPƯ (2), ta có: nAl(OH)3 = 2.nAl2O3 = 2.0,025 = 0,05 (mol).
– Theo PTPƯ (1), ta có: nNaOH = 3.nAl(OH)3 = 3.0,5 = 0,15 (mol).
⇒ CM (NaOH) = 0,15/0,2 = 0,75 (M).
- Trường hợp 2: NaOH dư, nên hòa tan một phần lượng kết tủa Al(OH)3
– Phương trình hoá học của phản ứng:
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl (1)
0,1(mol) 0,1
2Al(OH)3 + 2NaOH → 2NaAlO2 + 3H2O (2)
0,05(mol)
2Al(OH)3 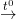 Al2O3 + 3H2O (3)
Al2O3 + 3H2O (3)
0,05 0,025 (mol)
– Theo PTPƯ (3) ta có: nAl(OH)3 = 2.nAl2O3 = 2.0,025 = 0,05 (mol).
Như vậy đã có: 0,1 – 0,05 = 0,05 (mol) Al(OH)3 đã bị hòa tan ở PTPƯ (2).
Từ (1) và (2) số mol NaOH là: nNaOH = 3.0,1 + 0,05 = 0,35 (mol)
⇒ Nồng độ mol/l C(M(NaOH))= 0,35/0,2 = 1,75 (M).
Bài 7 trang 129 SGK Hóa 12: Có 4 mẫu bột kim loại là Na, Al , Ca, Fe. Chỉ dùng nước làm thuốc thử, thì số kim loại có thể phân biệt được là bao nhiêu?
A. 1 B. 2 C. 3 D. 4
* Lời giải bài 7 trang 129 SGK Hóa 12:
- Đáp án: D. 4
– Trích mẫu thử rồi đổ nước vào từng mẫu thử
Kim loại nào phản ứng mạnh với nước, tạo dung dịch trong suốt là Na
Kim loại nào phản ứng mạnh với nước, tạo dung dịch trắng đục là Ca vì Ca(OH)2 ít tan, kết tủa trắng
Cho dd NaOH đến dư vào 2 mẫu thử còn lại, mẫu thử nào tác dụng tạo kết tủa rồi kết tủa tan, có giải phóng khí là Al.
Chất còn lại không phản ứng là Fe
– Các phương trình phản ứng:
Na + H2O → NaOH + ½H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
NaOH + Al + H2O → NaAlO2 + 3/2H2↑
Bài 8 trang 129 SGK Hóa 12: Điện phân Al2O3 nóng chảy với dòng điện cường độ 9,65 A trong thời gian 3000 giây, thu được 2,16 g Al. Hiệu suất của phản ứng là bao nhiêu?
A. 60% B. 70% C. 80% D. 90%
* Lời giải bài 8 trang 129 SGK Hóa 12:
- Đáp án: C. 80%
– Theo đinh luật Faraday khối lượng nhôm thu được là
mAl = AIt/96500n = (27.9,65.3000)/(96500.3) = 2,7(g)
⇒ Hiệu suất là H = (2,16/2,7).100% = 80%
– Nhắc lại công thức của định luật Faraday: m=AIt/nF
- m – khối lượng nhôm thu được ở điện cực
- A – Nguyên tử khối của nhôm = 27 g/mol
- I – Cường độ dòng điện
- t – Thời gian điện phân
- n – số electron của nhôm nhường
- F – Hằng số Faraday (F = 96500).
Hy vọng với bài viết hệ thống lại tính chất hoá học của Nhôm và các hợp chất Nhôm oxit, nhôm hidroxit ở trên hữu ích cho các em. Mọi thắc mắc và góp ý các em vui lòng để lại bình luận dưới bài viết để Tmdl.edu.vn ghi nhận và hỗ trợ, nếu bài viết hay hãy like và share nhé, chúc các em học tốt.
Bản quyền bài viết thuộc trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Tmdl.edu.vn (tmdl.edu.vn)
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





