Hoá 12 bài 31: Tính chất hoá học của Sắt Fe, bài tập về Sắt. Sắt Fe cũng có những tính chất hoá học tương tự như nhôm và được ứng dụng khá nhiều trong đời sống sản xuất vì chúng có khả năng dẫn điện, dẫn nhiệt lại dẻo và dễ dát mỏng.
Vậy sắt Fe có tính chất hoá học và tính chất vật lý cụ thể như thế nào, cách điều chế sắt ra sao và sắt được ứng dụng vào lĩnh vực nào trong đời sống sản xuất, chúng ta cùng tìm hiểu qua bài viết dưới đây.
Bạn đang xem bài: Hoá 12 bài 31: Tính chất hoá học của Sắt Fe, bài tập về Sắt
I. Vị trí của Sắt trong bảng HTTH
– Cấu hình e nguyên tử của sắt: 1s22s22p63s23p63d64s2.
– Vị trí: Fe thuộc ô 26, chu kì 4, nhóm VIIIB.
– Cấu hình e của các ion được tạo thành từ Fe:
Fe2+: 1s22s22p63s23p63d6
Fe3+: 1s22s22p63s23p63d5
II. Tính chất vật lí và trạng thái tự nhiên của Sắt
1. Tính chất vật lý của Sắt
– Màu trắng hơi xám, dẻo, dễ rèn, dễ dát mỏng, kéo sợi; dẫn nhiệt và dẫn điện kém đồng và nhôm.
– Sắt có tính nhiễm từ nhưng ở nhiệt độ cao (8000C) sắt mất từ tính. t0nc = 15400C.
– Sắt là kim loại nặng, khối lượng riêng D = 7,86g/cm3.
2. Trạng thái tự nhiên của Sắt
– Là kim loại phổ biến sau nhôm, tồn tại chủ yếu ở các dạng:
+ Hợp chất: oxit, sunfua, silicat…
+ Quặng: hematit đỏ (Fe2O3 khan), hematit nâu (Fe2O3.nH2O), manhetit (Fe3O4), xiđerit (FeCO3) và pirit (FeS2).
III. Tính chất hoá học của Sắt
– Fe là chất khử trung bình. Trong các phản ứng, Fe có thể nhường 2 hoặc 3e (Fe có hoá trị II hoặc III):
Fe → Fe3+ + 3e
Fe → Fe2+ + 2e
1. Sắt tác dụng với các phi kim
– Sắt tác dụng với hầu hết các phi kim khi đun nóng:
a) Sắt tác dụng với halogen → muối sắt (III) halogenua (trừ iot tạo muối sắt II):
+ Phương trình phản ứng tổng quát:
2Fe + 3X2 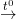 2FeX3
2FeX3
– Fe tác dụng với Clo: Fe + Cl2
2Fe + 3Cl2 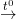 2FeCl3
2FeCl3
b) Sắt tác dụng với Oxi O2 (Fe + O2)
3Fe + 2O2 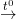 Fe3O4
Fe3O4
– Fe3O4 là oxit sắt từ, sắt có hoá trị II và hoá trị III
* Lưu ý: Thực tế khi giải các bài tập thường gặp trường hợp tạo ra hỗn hợp gồm Fe và các oxit sắt.
c) Sắt tác dụng với lưu huỳnh S (Fe + S)
Fe + S 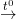 FeS
FeS
2. Tác dụng với nước
– Fe không tác dụng với nước ở nhiệt độ thường, ở nhiệt độ cao, sắt phản ứng mạnh với hơi nước:
3Fe + 4H2O ![small xrightarrow[]{<570^{0}C}](https://tmdl.edu.vn/wp-content/uploads/2023/03/giflatexsmallspacexrightarrow570_1550477609.gif) Fe3O4 + 4H2↑
Fe3O4 + 4H2↑
Fe + H2O ![small small xrightarrow[]{>570^{0}C} 1550477611lfil4fzz9l](https://tmdl.edu.vn/wp-content/uploads/2023/03/1550477611lfil4fzz9l.gif) FeO + H2↑
FeO + H2↑
3. Sắt tác dụng với dung dịch axit
a) Sắt tác dụng với axit HCl, H2SO4 loãng → muối sắt (II) + H2↑
– Fe tác dụng với HCl: Fe + HCl
Fe + 2HCl → FeCl2 + H2↑
– Fe tác dụng với H2SO4 : Fe + H2SO4
Fe + H2SO4 loãng → FeSO4 + H2↑
b) Sắt tác dụng với các axit có tính oxi hóa mạnh (HNO3, H2SO4 đậm đặc)
– Fe thụ động với H2SO4 đặc nguội và HNO3 đặc nguội → có thể dùng thùng Fe chuyên chở axit HNO3 đặc nguội và H2SO4 đặc nguội.
– Fe + HNO3 loãng → muối sắt (III) + NO↑ + H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO↑ + 2H2O
– Fe + HNO3 đậm đặc → muối sắt (III) + NO2↑ + H2O
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
– Fe + H2SO4 đậm đặc và nóng → muối sắt (III) + H2O + SO2↑
2Fe+ 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
* Lưu ý: Sản phẩm sinh ra trong phản ứng của Fe với HNO3 hoặc H2SO4 đậm đặc là muối sắt (III) nhưng nếu sau phản ứng có Fe dư hoặc có Cu thì tiếp tục xảy ra phản ứng:
2Fe3+ + Fe → 3Fe2+
Hoặc 2Fe3+ + Cu → 2Fe2+ + Cu2+
4. Sắt tác dụng với dung dịch muối
– Fe đẩy được những kim loại yếu hơn ra khỏi muối → muối sắt (II) + kim loại.
Fe + CuCl2 → Cu + FeCl2
– Fe tham gia phản ứng với muối Fe3+ → muối sắt (II):
2FeCl3 + Fe → 3FeCl2
* Chú ý: Với muối Ag+, Fe có thể tham gia phản ứng để tạo thành muối Fe3+:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag↓
IV. Điều chế và ứng dụng của sắt
1. Điều chế sắt bằng phương pháp nhiệt luyện
– Khử oxit sắt bằng các chất khử (Al, C, CO, H2) ở nhiệt độ cao, dùng để điều chế sắt trong công nghiệp
Fe3O4 + 4CO 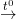 3Fe + 4CO2
3Fe + 4CO2
Fe2O3 + 3H2 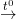 2Fe + 3H2O
2Fe + 3H2O
Fe2O3 + 2Al 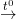 2Fe + Al2O3
2Fe + Al2O3
2. Điều chế sắt bằng phương pháp điện phân dung dịch
2FeSO4 + 2H2O –đpdd→ 2Fe + O2 + 2H2SO4
3. Ứng dụng của sắt
– Sắt là kim loại được sử dụng nhiều nhất, chiếm khoảng 95% tổng khối lượng kim loại sản xuất trên toàn thế giới. Sự kết hợp của giá thành thấp và các đặc tính tốt về chịu lực, độ dẻo, độ cứng làm cho nó trở thành không thể thay thế được, đặc biệt trong các ứng dụng như sản xuất ô tô, thân tàu thủy lớn, các bộ khung cho các công trình xây dựng. Thép là hợp kim nổi tiếng nhất của sắt, ngoài ra còn có một số hình thức tồn tại khác của sắt như:
- Gang thô (gang lợn) chứa 4% – 5% cacbon và chứa một loạt các chất khác như lưu huỳnh, silic, phốt pho.
- Gang đúc chứa 2% – 3.5% cacbon và một lượng nhỏ mangan.
- Thép carbon chứa từ 0,5% đến 1,5% cacbon, với một lượng nhỏ mangan, lưu huỳnh, phốt pho và silic.
- Sắt non chứa ít hơn 0,5% cacbon.
- Các loại thép hợp kim chứa các lượng khác nhau của cacbon cũng như các kim loại khác, như crôm, vanađi, môlipđen, niken, vonfram, v.v.
- Oxít sắt (III) được sử dụng để sản xuất các bộ lưu từ tính trong máy tính. Chúng thường được trộn lẫn với các hợp chất khác, và bảo tồn thuộc tính từ trong hỗn hợp này.
V. Bài tập về Sắt
Bài 1 trang 141 SGK Hóa 12: Các kim loại nào sau đây đều phản ứng với dung dịch CuCl2?
A. Na, Mg, Ag. B. Fe, Na, Mg.
C. Ba, Mg, Hg. D. Na, Ba, Ag.
* Lời giải bài 1 trang 141 SGK Hóa 12:
- Đáp án: B. Fe, Na, Mg
– Các phản ứng xảy ra:
Fe + CuCl2 → FeCl2 + Cu↓
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuCl2 → 2NaCl + Cu(OH)2↓
Mg + CuCl2 → MgCl2 + Cu↓
Bài 3 trang 141 SGK Hóa 12: Cho 3,52 gam một kim loại tác dụng hết với dung dịch H2SO4 loãng, thu được 6,84 gam muối sunfat. Kim loại đó là
A. Mg. B. Zn. C. Fe. D. Al.
* Lời giải bài 3 trang 141 SGK Hóa 12:
- Đáp án: C. Fe
– Gọi kim loại là M hóa trị là n
– Phương trình hoá học của phản ứng:
2M + nH2SO4 → M2(SO4)n + nH2↑
2M (g) (2M + 96n) (g)
2,52 (g) 6,84 (g)
⇒ ta có: 2M.6,84 = 2,52.(2M + 96n).
⇒ 13,68M = 5,04M +241,92n
⇒ 8,64M = 241,92n
⇒ M = 28n
– Cho n = 1, 2, 3 thì thấy chỉ n = 2 ⇒ M = 56 là thỏa mãn
⇒ Vậy kim loại là Fe
Bài 4 trang 141 SGK Hóa 12: Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68 %. Kim loại đó là :
A. Zn. B. Fe. C. Al. D. Ni.
* Lời giải bài 4 trang 141 SGK Hóa 12:
- Đáp án: B. Fe
– Theo bài ra, khối lượng kim loại giảm chính là khối lượng kim loại phản ứng với dd HCl
⇒ Khối lượng kim loại phản ứng là: mKL = (1,68%.50)/(100%) = 0,84(g)
– Theo bài ra, số mol H2 là: nH2 = 0,336/22,4 = 0,015 (mol)
– Phương trình hoá học của phản ứng:
2M + 2n HCl → 2MCl2 + nH2↑
– Theo PTPƯ số mol của M là: nM = (2/n).nH2 = (2. 0,015)/n = 0,03/n (mol).
⇒ M = 0,84/(0,03/n) = 28n
– Cho n = 1, 2, 3 thì thấy chỉ n = 2 ⇒ M = 56 là thỏa mãn
Bài 5 trang 141 SGK Hóa 12: Hỗn hợp A chứa Fe và kim loại M có hóa trị không đổi trong mọi hợp chất. Tỉ lệ số mol của M và Fe trong hỗn hợp là 1 : 3. Cho 19,2 gam hỗn hợp A tan hết vào dung dịch HCl thu được 8,96 lít khí H2 Cho 19,2 gam hỗn hợp A tác dụng hết với Cl2 thì cần dùng 13,32 lít khí Cl2. Xác định kim loại M và phần trăm khối lượng các kim loại trong hỗn hợp A. Các thể tích khí đo ở đktc.
* Lời giải bài 5 trang 141 SGK Hóa 12:
– Gọi hóa trị của M là n
– Gọi Gọi số mol của M là x thì số mol của Fe sẽ là 3x.
– Các phương trình hoá học của phản ứng:
Fe + 2HCl → FeCl2 + H2↑ (1)
3x 3x
2M + 2nHCl → 2MCln + nH2↑ (2)
x nx/2
2Fe + 3Cl2 → 2FeCl3 (3)
3.x (9/2)x
2M + nCl2 → 2MCln (4)
x (n/2)x
– Theo bài ra, số mol H2 là: nH2 = 8,96/22,4 = 0,4 (mol)
mà theo PTPƯ (1) và (2) thì: nH2 = 3x + 0,5nx = 0,4 (*)
– Theo bài ra, số mol Cl2 là: nCl2 = 12,32/22,4 = 0,55 (mol)
mà theo PTPƯ (3) và (4) thì: nCl2 = 4,5x + 0,5nx = 0,55 (**)
Từ (*) và (**) ⇒ x = 0,1 và n = 2
⇒ mFe = 3.0,1.56 = 16,8 (g).
⇒ mM = 19,2 – 16,8 = 2,4 (g).
⇒ MM = 2,4/0,1 = 24 (g/mol).
⇒ Vậy kim loại là Mg.
%mFe = (16,8/19,2).100% = 87,5%.
%mMg = 100% – 87,5% = 12,5%
Hy vọng với bài viết về tính chất hoá học của Sắt Fe và các bài tập về Sắt ở trên giúp ích cho các em. Mọi thắc mắc hay góp ý các em hãy để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-12-bai-31/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục