Hoá 8 bài 24: Tính chất hoá học của Oxi (O2), tính chất vật lý và bài tập về Oxi. Oxi (O2) là nguyên tố hoá học phổ biến và chiếm 49,4% khối lượng vỏ trái đất, Oxi có vai trò quan trọng giúp duy trì sự sống của động thực vật. Oxi là chất khí không màu, không mùi, ít tan trong nước và nặng hơn không khí.
Vậy Oxi (O2) có tính chất hoá học và tính chất vật lý gì? Oxi có vai trò như thế nào đối với sự sống của con người, chúng ta cùng tìm hiểu qua bài viết dưới đây.
Bạn đang xem bài: Hoá 8 bài 24: Tính chất hoá học của Oxi (O2), tính chất vật lý và bài tập về Oxi
• Sơ lược nguyên tố Oxi
– Ký hiệu nguyên tố Oxi: O
– Công thức đơn chât (phân tử): O2
– Nguyên tử khối của Oxi: 16
– Phân tử khối của Oxi: 32
I. Tính chất vật lý của Oxi (O2)
– Oxi là một chất không màu, không mùi, ít tan trong nước.
– Oxi có khối lượng phân tử là 32 nên oxi nặng hơn không khí.
– Oxi khi bị hóa lỏng ở nhiệt độ -1830C sẽ có màu xanh nhạt và có thể bị hút bởi nam châm.
II. Tính chất hoá học của Oxi (O2)
- Oxi tác dụng với kim loại
- Oxi tác dụng với Phi kim
- Oxi tác dụng với các hợp chất khác
1. Oxi tác dụng với kim loại
– Oxi có thể tác dụng với hầu hết các kim loại dưới tác dụng của nhiệt độ để tạo ra các oxit (trừ một số kim loại như vàng (ký hiệu: Au) hay bạch kim (ký hiệu: Pt) Oxi không phản ứng), ví dụ:
2O2 + 3Fe ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) Fe3O4
Fe3O4
O2 + 4Ag ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) 2Ag2O
2Ag2O
O2 + 2Mg ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) 2MgO
2MgO
3O2 + 4Al ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) 2Al2O3
2Al2O3
2. Oxi tác dụng với phi kim
– Oxi cũng có thể phản ứng trực tiếp với hầu hết các phi kim, chỉ trừ nhóm halogen (Flo, Clo, Brom, Iot và Atatin) là Oxi không phản ứng, và sản phẩm được tạo thành là các oxit axit, ví dụ:
5O2 + 4P ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) 2P2O5
2P2O5
O2 + S ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) SO2
SO2
O2 + C ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) CO2
CO2
3. Oxi tác dụng với các hợp chất khác
– Oxi còn có thể tác dụng với các chất có tính khử hoặc các hợp chất hữu cơ để tạo thành những hợp chất mới, ví dụ:
3O2 + 2H2S → 2SO2↑ + 2H2O
O2 + 2SO2 → 2SO3↑
2O2 + CH4 ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) CO2↑ + 2H2O
CO2↑ + 2H2O
O2 + C2H5OH ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) CO2↑ + 2H2O
CO2↑ + 2H2O
(C2H5OH là rượu Etylic, CH4 là metan các em sẽ học ở các lớp sau)
III. Vài trò của Oxi với sự sống
– Oxi có khả năng kết hợp với hemoglobin (hêmôglôbin) trong máu, nhờ thế nó có thể đi nuôi cơ thể người và động vật. Oxi oxi hoá các chất thực phẩm ở trong cơ thể tạo năng lượng cho cơ thể hoạt động.
– Oxi còn tham gia vào hoạt động hô hấp và việc phân hủy trong tự nhiên. Trong không khí, oxi là sản phẩm của quá trình quang hợp (ở cây xanh).
– Ngoài ra, oxi còn được dùng trong y tế để làm chất duy trì hô hấp. Oxi được dùng trong các bình lặn của thợ lặn, hay sử dụng làm ống thở cho phi công trong những trường hợp không khí loãng,… Đặc biệt, oxi cũng được dùng nhiều trong công nghiệp luyện kim, công nghiệp sản xuất thép hay sản xuất rượu.
IV. Bài tập về Oxi (O2)
Bài 1 trang 84 SGK hoá 8: Dùng từ thích hợp trong khung để điền vào chỗ trống trong các câu sau:
Kim loại, phi kim, rất hoạt động, phi kim rất hoạt động, hợp chất, nhiều chất
Khí oxi là một đơn chất … tham gia phản ứng hóa học với … có thể phản ứng với …
* Lời giải bài 1 trang 84 SGK hoá 8:
Khí oxi là một đơn chất rất hoạt động, tham gia phản ứng hóa học với nhiều chất. Oxi có thể phản ứng với phi kim, kim loại, hợp chất.
Bài 2 trang 84 SGK hoá 8: Nêu các thí dụ chứng minh rằng oxi là một đơn chất rất hoạt động (đặc biệt ở nhiệt độ cao)
* Lời giải bài 2 trang 84 SGK hoá 8:
Oxi là một đơn chất rất hoạt động (đặc biệt ở nhiệt độ cao), ví dụ:
3Fe + 2O2 → Fe3O4.
S + O2 → SO2.
Bài 3 trang 84 SGK hoá 8: Butan có công thức C4H10 khi cháy tạo ra khí cacbonic và hơi nước, đồng thời tỏa nhiều nhiệt. Viết phương trình hóa học biểu diễn sự cháy của butan.
* Lời giải bài 3 trang 84 SGK hoá 8:
– Phương trình hóa học phản ứng cháy của Butan C4H10:
2C4H10 + 13O2 ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) 8CO2 + 10H2O
8CO2 + 10H2O
Bài 4 trang 84 SGK hoá 8: Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5(là chất rắn, trắng).
a) Photpho hay oxi chất nào còn thừa và số mol chất còn thừa là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
* Lời giải bài 4 trang 84 SGK hoá 8:
a) Phương trình phản ứng đốt cháy Photpho:
4P + 5O2 ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) 2P2O5
2P2O5
– Theo bài ra, đốt cháy 12,4g photpho trong bình chứa 17g khí oxi nên ta có:
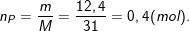
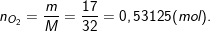
– Ta lập tỉ lệ số mol O2 và P
– Theo PTPƯ thì: 4 mol P cần 5 mol O2
– Theo bài ra có: 0,4 mol P và 0,53125 mol O2
⇒ Tỉ số mol của P và O2 là:
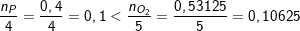
⇒ Photpho phản ứng hết Oxi dư, tính khối lượng chất tạo thành theo photpho
⇒ nO2 (phản ứng) = 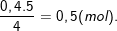
⇒ nO2 (dư) = nO2 (bài ra) – nO2 (phản ứng) = 0,53125 – 0,5 = 0,03135 (mol)
b) Chất tạo thành là điphotpho pentaoxit P2O5
– Theo PTPƯ: 4 mol P tạo thành 2 mol P2O5 nên:
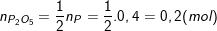
⇒ mP2O5 = n.M = 0,2.(31.2 + 16.5) = 0,2.(62 + 80) = 28,4 (g)
Bài 5 trang 84 SGK hoá 8: Đốt cháy hoàn toàn 24kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được. Tính thể tích khí CO2 và SO2 tạo thành (ở điều kiện tiêu chuẩn).
* Lời giải bài 5 trang 84 SGK hoá 8:
– Ta có PTPƯ:
C + O2 ![small xrightarrow[]{t^{0}} 1557974561tywd29b79x 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557974561tywd29b79x-1.gif) CO2
CO2
12g 22,4(l)
196 mol ?
– Lưu ý đổi 24kg = 24000g và than đá chiếm 100% – 0,5% (lưu huỳnh) – 1,5% (chất khác) = 98% nên – lượng cacbon nguyên chất là::
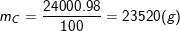
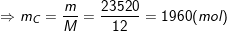
⇒ VCO2 = n.22,4 = 1960.22,4 = 43904 (l).
– Ta có PTPƯ:
S + O2 → SO2
1mol 22,4(l)
3,73mol ?
– Theo bài ra: 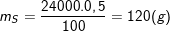
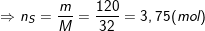
– Theo phương trình phản ứng: nSO2 = nS = 3,75 (mol).
⇒ VSO2 = 22,4.n = 22,4.3,75 = 84 (lít).
Bài 6 trang 84 SGK hoá 8: Giải thích tại sao:
a) Khi nhốt một con dế mèn (hoặc con châu chấu) vào một lọ nhỏ rồi đậy nút kín, sau một thời gian con vật sẽ chết.
b) Người ta phải bơm sục không khí vào các bể nuôi cá cảnh hoặc các chậu, bể chứa cá sống ở các cửa hàng bán cá.
* Lời giải bài 6 trang 84 SGK hoá 8:
a) Con dế mèn sẽ chết vì thiếu khí oxi. Khí oxi duy trì sự sống.
b) Phải bơm sục không khí vào các bể nuôi cá để cung cấp oxi cho cá (vì oxi tan một phần trong nước.
Hy vọng với bài viết về tính chất hoá học, tính chất vật lý của Oxi và bài tập ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-8-bai-24-tinh-chat-hoa-hoc-cua-oxi-o2-tinh-chat-vat-ly-va-bai-tap-ve-oxi/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục