Hoá 8 bài 27: Điều chế, sản xuất Oxi (O2) trong phòng thí nghiệm và trong công nghiệp. Như đã biết Oxi đóng vai trò quan trọng giúp duy trì sự sống của động vật, Oxi có nhiều trong không khí nhưng làm sao để có thể tách riêng Oxi để sử dụng, hay điều chế và sản xuất Oxi từ nước và hợp chất của chúng.
Bài viết dưới đây sẽ cho các em biết phương pháp để điều chế, sản xuất Oxi trong phòng thí nghiệm và trong công nghiệp, đồng thời các em biết thêm 1 loại phản ứng mới, đó là phản ứng phân huỷ.
Bạn đang xem bài: Hoá 8 bài 27: Điều chế, sản xuất Oxi (O2) trong phòng thí nghiệm và trong công nghiệp
I. Điều chế và sản xuất Oxi (O2) trong phòng thí nghiệm
– Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao như KMnO4 và KClO3.
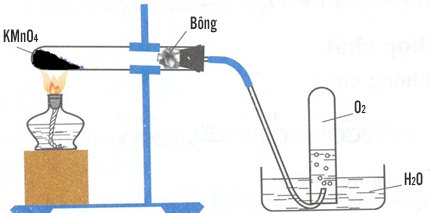
Điều chế Oxi trong phòng thí nghiệm
– Điều chế Oxi từ nguyên liệu là kali pemanganat KMnO4
2KMnO4 ![small xrightarrow[]{t^{0}} 1557994791fo63cuhvv5 1631769779](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557994791fo63cuhvv5_1631769779.gif) K2MnO4 + MnO2 + O2.
K2MnO4 + MnO2 + O2.
– Điều chế Oxi bằng từ nguyên liệu là kali clorat KClO3
2KClO3 ![small xrightarrow[]{t^{0}} 1557994791fo63cuhvv5 1631769779](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557994791fo63cuhvv5_1631769779.gif) 2KCl + 3O2.
2KCl + 3O2.
* Cách 2 cách thu khí Oxi:
+ Bằng cách đẩy không khí.
+ Bằng cách đẩy nước.
II. Điều chế và sản xuất Oxi (O2) trong công nghiệp
* Trong công nghiệp để điều chế và sản xuất Oxi người ta sử dụng nguyên liệu là Không khí và nước.
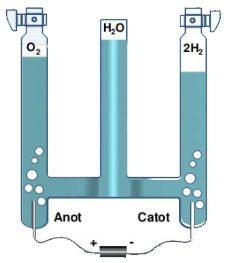 điều chế oxi trong công nghiệp
điều chế oxi trong công nghiệp
1. Sản xuất khí oxi từ không khí.
– Người ta hoá lỏng không khí ở nhiệt độ thấp và áp suất cao, sau đó cho không khí lòng bay hơi, đầu tiên thu được khí Nito (-1960C) sau đó là khí Oxi (-1830C).
2. Sản xuất khí oxi từ nước.
– Điện phân nước trong các bình điện phân, thu được 2 chất khí riêng biệt là Oxi và Hidro
2H2O ![small xrightarrow[]{t^{0}} 1557994791fo63cuhvv5 1631769779](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557994791fo63cuhvv5_1631769779.gif) 2H2 + O2
2H2 + O2
– Khí Oxi dùng trong công nghiệp thường được hoá lỏng và được nén dưới áp suất cao trong các bình thép.
III. Phản ứng phân huỷ
– Phản ứng phân huỷ là gì: Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới;
* Ví dụ:
2KMnO4 ![small xrightarrow[]{t^{0}} 1557994791fo63cuhvv5 1631769779](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557994791fo63cuhvv5_1631769779.gif) K2MnO4 + MnO2 + O2.
K2MnO4 + MnO2 + O2.
2KClO3 ![small xrightarrow[]{t^{0}} 1557994791fo63cuhvv5 1631769779](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557994791fo63cuhvv5_1631769779.gif) 2KCl + 3O2.
2KCl + 3O2.
2H2O ![small xrightarrow[]{t^{0}} 1557994791fo63cuhvv5 1631769779](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557994791fo63cuhvv5_1631769779.gif) 2H2 + O2
2H2 + O2
2Fe(OH)3 ![small xrightarrow[]{t^{0}} 1557994791fo63cuhvv5 1631769779](https://tmdl.edu.vn/wp-content/uploads/2023/03/1557994791fo63cuhvv5_1631769779.gif) Fe2O3 + 3H2O
Fe2O3 + 3H2O
IV. Bài tập vận dụng điều chế và sản xuất Oxi
Bài 1 trang 99 SGK hoá 8: Chọn câu trả lời đúng trong các câu sau đây về thành phần của không khí:
A. 21% khí nitơ, 78% oxi, 1% các khí khác (CO2, CO, khí hiếm,…).
B. 21% các khí khác, 78% khí nitơ, 1% khí oxi.
C. 21% khí oxi, 78% khí nitơ, 1% các khí khác.
D. 21% khí oxi, 78% các khí khác, 1% khí nitơ.
* Lời giải bài 1 trang 99 SGK hoá 8:
– Đáp án: C. 21% khí oxi, 78% khí nitơ, 1% các khí khác.
Bài 2 trang 99 SGK hoá 8: Không khí bị ô nhiễm có thể gây ra những tác hại gì? Phải làm gì để bảo vệ không khí trong lành?
* Lời giải bài 2 trang 99 SGK hoá 8:
– Không khí bị ô nhiễm, không những gây tác hại đến sức khỏe con người và đời sống thực vật mà còn phá hoại dần những công trình xây dựng như cầu cống, nhà cửa, di tích lịch sử,…
• Bảo vệ không khí trong lành ta phải làm:
– Phải xử lí khí thải các nhà máy các lò đốt, các phương tiện giao thông,… để hạn chế mức thấp nhất việc thải ra khí quyển các khí có hại như CO, CO2, bụi, khói,…
– Bảo vệ rừng trồng rừng, trồng cây xanh, là những biện pháp tích cực bảo vệ không khí trong lành.
Bài 3 trang 99 SGK hoá 8: Giải thích vì sao sự cháy trong không khí xảy ra chậm hơn và tạo ra nhiệt độ thấp hơn so với sự cháy trong oxi.
* Lời giải bài 3 trang 99 SGK hoá 8:
– Sự cháy trong không khí xảy ra chậm hơn và tạo ra nhiệt độ thấp hơn so với sự cháy trong oxi. Đó là vì trong không khí, thể tích khí nitơ gấp 4 lần khí oxi, diện tích tiếp xúc của chất cháy với các phân tử oxi ít hơn nhiều lần nên sự cháy diễn ra chậm hơn. Một phần nhiệt tiêu hao để đốt nóng khí nitơ nên nhiệt độ đạt được thấp hơn.
Bài 4 trang 99 SGK hoá 8: Điểm giống nhau và khác nhau giữa sự cháy và sự oxi hóa chậm là gì?
* Lời giải bài 4 trang 99 SGK hoá 8:
– Điểm giống nhau giữa sự cháy và sự oxi hóa chậm: đều là sự oxi hóa có tỏa nhiệt.
– Điểm khác nhau giữa sự cháy và sự oxi hóa chậm: sự oxi hóa chậm không phát sáng còn sự cháy có phát sáng.
Bài 5 trang 99 SGK hoá 8: Những điều kiện cần thiết để cho một vật có thể cháy và tiếp tục cháy là gì?
* Lời giải bài 5 trang 99 SGK hoá 8:
– Điều kiện cần thiết cho một vật có thể cháy được và tiếp tục cháy được: chất phải nóng đến nhiệt độ cháy, phải đủ khí oxi cho sự cháy.
Bài 6 trang 99 SGK hoá 8: Muốn dập tắt ngọn lửa trên người hoặc ngọn lửa do xăng dầu cháy, người ta thường trùm vải dày hoặc phủ cát lên ngọn lửa, mà không dùng nước. Giải thích vì sao?
* Lời giải bài 6 trang 99 SGK hoá 8:
– Không dùng nước là vì xăng dầu không tan trong nước, có thể làm cho đám cháy lan rộng. Thường trùm vải dày hoặc phủ lớp cát lên ngọn lửa để cách li ngọn lửa và không khí – đó là một trong hai điều kiện dập tắt đám cháy.
Bài 7 trang 99 SGK hoá 8: Mỗi giờ 1 người lớn tuổi hít vào trung bình 0,5m3 không khí cơ thể giữ lại 1/3 lượng oxi có trong không khí đó. Như vậy thực tế mỗi người trong một ngày đêm cần trung bình:
a) Một thể tích không khí là bao nhiêu?
b) Một thể tích khí oxi là bao nhiêu?
(Giả sử các thể tích khí được đo ở đktc)
* Lời giải bài 7 trang 99 SGK hoá 8:
– Lượng không khí cần dùng trong 1 ngày (24 giờ) cho mỗi người là: 0,5m3.24 = 12m3.
– Cơ thể giữ lại 1/3 nên lượng không khí giữ lại là: 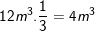
– Oxi chiếm 21% thể tích không khí, nên lượng oxi cần dùng trong 1 ngày cho một người trung bình là:
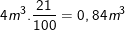
Hy vọng với bài viết về Điều chế, sản xuất Oxi (O2) trong phòng thí nghiệm và trong công nghiệp và bài tập ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-8-bai-27-dieu-che-san-xuat-oxi-o2-trong-phong-thi-nghiem-va-trong-cong-nghiep/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




 ️ 30+ Bài Văn Mẫu Hay Nhất
️ 30+ Bài Văn Mẫu Hay Nhất