Hóa 8 bài 42: Cách tính nồng độ phần trăm, nồng độ mol của dung dịch. Nồng độ mol và nồng độ phần trăm của dung dịch là khái niệm quan trọng mà các em cần nắm vững để giải nhiều bài toán liên quan đến tính nồng độ mol, hay nồng độ phần trăm của dung dịch trước và sau phản ứng.
Vậy nồng độ dung dịch là gì? công thức và cách tính nồng độ mol, nồng độ phần trăm của dung dịch như thế nào? làm sao để tìm nồng độ dung dịch sau phản ứng, chúng ta cùng tìm hiểu qua bài viết này. Đồng thời, vận dụng giải các bài tập liên quan đến tính nồng độ mol, nồng độ phần trăm của dung dịch trước và sau phản ứng hóa học.
Bạn đang xem bài: Hóa 8 bài 42: Cách tính nồng độ phần trăm, nồng độ mol của dung dịch
I. Nồng độ phần trăm của dung dịch
1. Ý nghĩa của nồng độ phần trăm
– Nồng độ phần trăm của dung dịch cho ta biết số gam chất tan có trong 100 gam dung dịch.
2. Công thức tính nồng độ phần trăm
+ Công thức: C% = 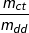 .100%
.100%
– Trong đó:
C% là nồng độ phần trăm của dung dịch
mct là Khối lượng chất tan (gam)
mdd là Khối lượng dung dịch (gam); mdd = mdung môi + mchất tan
+ Các công thức suy ra từ công thức tính nồng độ phần trăm
– Công thức tính khối lượng chất tan:mct = (C%.mdd):100%
– Công thức tính khối lượng dung dịch: mdd = (mct.100%):C%
3. Một số ví dụ vận dụng công thức tính nồng độ phần trăm
– Ví dụ 1: Hoà tan 10 gam đường vào 40 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
* Lời giải: Theo bài ra, ta có: mdd = mdm + mct = 40+10=50 (gam).
– Áp dụng công thức tính nồng độ phần trăm, ta có:
C% = 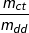 .100% = (10.100) : 50 = 20%
.100% = (10.100) : 50 = 20%
– Ví dụ 2: Tính khối lượng NaOH có trong 200 gam dd NaOH 15%
* Lời giải: Theo bài ra, ta có:
mNaOH = (C%.mdd):100 = (15%.200):100% = 30 (gam).
– Ví dụ 3: Hoà tan 20 gam muối vào nước được dd có nồng độ 10%
a) Tính khối lượng dd nước muối thu được
b) Tính khối lượng nước cần dựng cho sự pha chế
* Lời giải: Theo bài ra, ta có:
a) mdd=(mmuối.100%):C% = (20.100%):10% = 200 (gam).
b) mnước=mdd-mmuối = 200-20 = 180 (gam).
II. Nồng độ Mol của dung dịch
1. Ý nghĩa của nồng độ mol dung dịch
– Nồng độ mol của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch
2. Công thức tính nồng nộ mol dung dịch
+ Công thức: 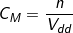 (mol/l).
(mol/l).
– Trong đó:
CM : là nồng độ mol
n : là số mol chất tan
Vdd : là thể tích dung dịch (lít)
+ Các công thức suy ra từ công thức tính nồng độ mol của dung dịch
– Công thức tính số mol chất tan: n = CM.Vdd (mol).
– Công thức tính thể tích dung dịch:  (lít).
(lít).
3. Một số ví dụ vận dụng công thức tính nồng độ mol
– Ví dụ 1: Trong 200 ml dd có hoà tan 16 gam NaOH. Tính nồng độ mol của dd.
* Lời giải:
– Đổi: 200ml=0,2 lít; theo bài ra, ta có:
nNaOH=16/40=0,4 (mol).
– Áp dụng công thức tính nồng độ mol: CM=n/V=0,4/0,2 = 2 (M).
– Ví dụ 2: Tính khối lượng H2SO4 có trong 50ml dd H2SO4 2M
* Lời giải:
– Tính số mol H2SO4 có trong dd H2SO4 2M.
nH2SO4 = CM.V=2.0,05 =0,1 (mol).
⇒ mH2SO4 = n.M=0,1.98=9,8 (gam).
III. Bài tập tính nồng độ phần trăm và nồng độ mol dung dịch
Bài 1 trang 145 sgk hoá 8: Bằng cách nào có được 200g dung dịch BaCl2 5%.
A. Hòa tan 190g BaCl2 trong 10g nước.
B. Hòa tan 10g BaCl2 trong 190g nước.
C. Hoàn tan 100g BaCl2 trong 100g nước.
D. Hòa tan 200g BaCl2 trong 10g nước.
E. Hòa tan 10g BaCl2 trong 200g nước.
* Lời giải bài 1 trang 145 sgk hoá 8:
– Đáp án đúng: B.Hòa tan 10g BaCl2 trong 190g nước.
– Áp dụng công thức suy ra từ CT tính nồng độ phần trăm, ta có:
mct = (C%.mdd)/100% = (5%.200)/100% = 10 (g).
mà mdd = mct + mnước ⇒ mnước = mdd – mct = 200 – 10 = 190 (g).
Bài 2 trang 145 sgk hoá 8: Tính nồng độ mol của 850ml dung dịch có hòa tan 20g KNO3.Kết quả là:
a) 0,233M. b) 23,3M.
c) 2,33M. d) 233M.
* Lời giải bài 2 trang 145 sgk hoá 8:
– Đáp số đúng: a. 0,233M.
– Theo bài ra, ta có:nKNO3 = 20/101 = 0,198 (mol).
– 850 ml = 0,85 (lít) ⇒ CM (KNO3) = n/V = 0,198/0,85 = 0,233 (M).
Bài 3 trang 146 sgk hoá 8: Hãy tính nồng độ mol của mỗi dung dịch sau:
a) 1 mol KCl trong 750ml dung dịch.
b) 0,5 mol MgCl2 trong 1,5 lít dung dịch.
c) 400g CuSO4 trong 4 lít dung dịch.
d) 0,06 mol Na2CO3 trong 1500ml dung dịch.
* Lời giải bài 3 trang 146 sgk hoá 8:
– Áp dụng công thức tính nồng độ mol: CM = n/V.
– Lưu ý: các em nhớ đổi đơn vị thể tích từ ml sang lít.
a) 1 mol KCl ⇒ nKCl = 1; 750ml dung dịch = 0,75 lít dung dịch ⇒ Vdd = 0,75 (l).
⇒ CM (KCl) = n/V = 1/0,75 = 1,33 (M).
b) CM (MgCl2) = n/V = 0,5/1,5 = 1,33 (M).
c) nCuSO4 = 400/160 = 2,5 (mol)
⇒ CM (CuSO4) = 2,5/4 = 0,625 (M).
d) CM (Na2CO3) = 0,06/1,5 = 0,04 (M).
Bài 4 trang 146 sgk hoá 8: Hãy tính số mol và số gam chất tan trong mỗi dung dịch sau:
a) 1 lít dung dịch NaCl 0,5M.
b) 500ml dung dịch KNO3 2M.
c) 250ml dung dịch CaCl2 0,1M.
d) 2 lít dung dịch Na2SO4 0,3M.
* Lời giải bài 4 trang 146 sgk hoá 8:
– Áp dụng công thức suy ra từ công thức tính nồng độ mol: n = CM.V
– Và công thức tính khối lượng: m = n.M
a) 1 lít dung dịch NaCl 0,5M ⇒ Vdd = 1 lít; CM = 0,5M.
⇒ nNaCl = CM.V = 1.0,5 = 0,5 (mol) ⇒ mNaCl = m = n.MNaCl = 0,5.(23 +35,5) = 29,25 (g).
b) nKNO3 = 2.0,5 = 1 (mol) ⇒ mKNO3 = 1.101 = 101 (g).
c) nCaCl2 = 0,1.0,25 = 0,025 (mol) ⇒ mCaCl2 = 0,025.(40 + 71) = 2,775 (g).
d) nNa2SO4 = 0,3.2 = 0,6 (mol) ⇒ mNa2SO4 = 0,6.142 = 85,2 (g).
Bài 5 trang 146 sgk hoá 8: Hãy tính nồng độ phần trăm của những dung dịch sau:
a) 20g KCl trong 600g dung dịch.
b) 32g NaNO3 trong 2kg dung dịch.
c) 75g K2SO4 trong 1500g dung dịch.
* Lời giải bài 5 trang 146 sgk hoá 8:
– Áp dụng công thức tính nồng độ phần trăm.
– Lưu ý: đổi đơn vị khối lượng từ kg sang gam.
a) C% (KCl) = (mct.100%)/mdd = (20.100%)/60 = 3,33%
b) 2kg = 2000 (g).
⇒ C% (NaNO3) = (32.100%)/2000 = 1,6%
c) C% (K2SO4) = (75.100%)/1500 = 5%.
Bài 6 trang 146 sgk hoá 8: Tính số gam chất tan cần dùng để pha chế mỗi dung dịch sau:
a) 2,5 lít dung dịch NaCl 0,9M.
b) 50g dung dịch MgCl2 4%.
c) 250ml dung dịch MgSO4 0,1M.
* Lời giải bài 6 trang 146 sgk hoá 8:
– Áp dụng công thức suy ra từ công thức tính nồng độ mol và nồng độ phần trăm.
mct = n.V; mct = (mdd.C%)/100%
– Số gam chất tan cần dùng để pha chế các dung dịch:
a) nNaCl = CM .V = 2,5.0,9 = 2,25 (mol).
⇒ mNaCl = 2,25.(23 + 35,5) = 131,625 (g).
b) mMgCl2 = (50.4%)/100% = 2 (g).
c) nMgSO4 = n.V = 0,1.0,25 = 0,025 (mol)
⇒ mMgSO4 = n.M = 0,025.(24 + 64 + 32) = 3 (g).
Bài 7 trang 146 sgk hoá 8: Ở nhiệt độ 25oC độ tan của muối ăn là 36g của đường là 204g. Hãy
tính nồng đồ phần trăm của các dung dịch bão hòa muối ăn và đường ở nhiệt độ trên.
* Lời giải bài 7 trang 146 sgk hoá 8:
– Muối ăn là NaCl, theo bài ra, ta có:
mdd (muối ăn bão hoà) = 100 + 36 = 136 (g).
⇒ C% (NaCl) = (mct.100%)/mdd = (36.100%)/136 = 26,47%.
mdd (đường bão hoà) = 100 + 204 = 304 (g).
⇒ C% (đường) = (204.100%)/304 = 67,1%.
Hy vọng với bài viết về cách tính nồng độ phần trăm và nồng độ mol của dung dịch và vận dụng giải bài tập ở trên giúp các em tự tin hơn khi gặp các dạng toán này. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ. Chúc các em học tập tốt!
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-8-bai-42-cach-tinh-nong-do-phan-tram-nong-do-mol-cua-dung-dich/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





