Hoá 8 bài 5: Nguyên tố hoá học, bảng ký hiệu, nguyên tử khối và bài tập vận dụng. Trong thực tế, khi mua thực phẩm đóng hộp các em thường thấy trên nhãn có ghi hàm lượng, thực chất đó chính là các nguyên tố hoá học, các nguyên tố hoá học này chính là tập hợp các nguyên tử cùng loại.
Vậy các nguyên tố hoá học là gì, có ký hiệu như thế nào và nguyên tử khối của chúng bằng bao nhiêu? chúng ta cùng tìm hiểu chi tiết qua bài viết dưới đây nhé.
Bạn đang xem bài: Hoá 8 bài 5: Nguyên tố hoá học, bảng ký hiệu, nguyên tử khối và bài tập vận dụng
I. Nguyên tố hoá học là gì?
– Định nghĩa: Nguyên tố hoá học là tập hợp các nguyên tử cùng loại có cùng số hạt proton trong hạt nhân. Số proton trong hạt nhân là đặc trưng của nguyên tố.
– Các nguyên tử thuộc cùng 1 nguyên tố hoá học có tính chất hoá học như nhau
II. Ký hiệu hoá học của các nguyên tố
– Mỗi nguyên tố hoá học thường được biểu diễn ngắn gọn bằng 1 hoặc 2 chữ cái (chữ cái đầu viết hoa), gọi là ký hiệu hoá học của nguyên tố, ví dụ:
Ký hiệu hoá học của Nguyên tố Hiđro là H, nguyên tố Canxi là Ca, nguyên tố Cacbon là C,…
– Theo quy ước, mỗi ký hiệu của nguyên tố còn chỉ 1 nguyên tử của nguyên tố đó, ví dụ: Muốn chỉ 2 nguyên tử của Hidro ta viết 2H.
* Bảng ký hiệu hoá học các nguyên tố Tiếng Anh và Tiếng Việt
| Tên tiếng Anh | Tên Tiếng Việt | Ký hiệu nguyên tố | Số proton |
| actinium | actini | Ac | 89 |
| americium | americi | Am | 95 |
| stibium | antimon | Sb | 51 |
| argonum | agon | Ar | 18 |
| arsenicum | asen | As | 33 |
| astatium | astatin | At | 85 |
| baryum | bari | Ba | 56 |
| berkelium | berkeli | Bk | 97 |
| beryllium | berylli | Be | 4 |
| bismuthum | bitmut | Bi | 83 |
| bohrium | bohri | Bh | 107 |
| borum | bo | B | 5 |
| bromum | brôm | Br | 35 |
| carboneum | cacbon | C | 6 |
| cerium | xeri | Ce | 58 |
| caesium | xêzi | Cs | 55 |
| stannum | thiếc | Sn | 50 |
| curium | curium | Cm | 96 |
| darmstadtium | darmstadti | Ds | 110 |
| kalium | kali | K | 19 |
| dubnium | dubni | Db | 105 |
| nitrogenium | nitơ | N | 7 |
| dysprosium | dysprosi | Dy | 66 |
| einsteinium | einsteini | Es | 99 |
| erbium | erbi | Er | 68 |
| europium | europi | Eu | 63 |
| fermium | fermi | Fm | 100 |
| fluorum | flo | F | 9 |
| phosphorus | phốtpho | P | 15 |
| francium | franxi | Fr | 87 |
| gadolinium | gadolini | Gd | 64 |
| gallium | galli | Ga | 31 |
| germanium | germani | Ge | 32 |
| hafnium | hafni | Hf | 72 |
| hassium | hassi | Hs | 108 |
| helium | heli | He | 2 |
| aluminium | nhôm | Al | 13 |
| holmium | holmi | Ho | 67 |
| magnesium | magiê | Mg | 12 |
| chlorum | clo | Cl | 17 |
| chromium | crom | Cr | 24 |
| indium | indi | In | 49 |
| iridium | iridi | Ir | 77 |
| iodum | iốt | I | 53 |
| cadmium | cadmi | Cd | 48 |
| californium | californi | Cf | 98 |
| cobaltum | coban | Co | 27 |
| krypton | krypton | Kr | 36 |
| silicium | silic | Si | 14 |
| oxygenium | ôxy | O | 8 |
| lanthanum | lantan | La | 57 |
| laurentium | lawrenci | Lr | 103 |
| lithium | liti | Li | 3 |
| lutetium | luteti | Lu | 71 |
| manganum | mangan | Mn | 25 |
| cuprum | đồng | Cu | 29 |
| meitnerium | meitneri | Mt | 109 |
| mendelevium | mendelevi | Md | 101 |
| molybdaenum | molypden | Mo | 42 |
| neodymium | neodymi | Nd | 60 |
| neon | neon | Ne | 10 |
| neptunium | neptuni | Np | 93 |
| niccolum | niken | Ni | 28 |
| niobium | niobi | Nb | 41 |
| nobelium | nobeli | No | 102 |
| plumbum | chì | Pb | 82 |
| osmium | osmi | Os | 76 |
| palladium | paladi | Pd | 46 |
| platinum | bạch kim | Pt | 78 |
| plutonium | plutoni | Pu | 94 |
| polonium | poloni | Po | 84 |
| praseodymium | praseodymi | Pr | 59 |
| promethium | promethi | Pm | 61 |
| protactinium | protactini | Pa | 91 |
| radium | radi | Ra | 88 |
| radon | radon | Rn | 86 |
| rhenium | rheni | Re | 75 |
| rhodium | rhodi | Rh | 45 |
| roentgenium | roentgeni | Rg | 111 |
| hydrargyrum | thủy ngân | Hg | 80 |
| rubidium | rubidi | Rb | 37 |
| ruthenium | rutheni | Ru | 44 |
| rutherfordium | rutherfordi | Rf | 104 |
| samarium | samari | Sm | 62 |
| seaborgium | seaborgi | Sg | 106 |
| selenium | selen | Se | 34 |
| sulphur | lưu huỳnh | S | 16 |
| scandium | scandi | Sc | 21 |
| natrium | natri | Na | 11 |
| strontium | stronti | Sr | 38 |
| argentum | bạc | Ag | 47 |
| tantalum | tantali | Ta | 73 |
| technetium | tecneti | Tc | 43 |
| tellurium | telua | Te | 52 |
| terbium | terbi | Tb | 65 |
| thallium | tali | Tl | 81 |
| thorium | thori | Th | 90 |
| thulium | thuli | Tm | 69 |
| titanium | titan | Ti | 22 |
| uranium | urani | U | 92 |
| vanadium | vanadi | V | 23 |
| calcium | canxi | Ca | 20 |
| hydrogenium | hiđrô | H | 1 |
| wolframium | volfram | W | 74 |
| xenon | xenon | Xe | 54 |
| ytterbium | ytterbi | Yb | 70 |
| yttrium | yttri | Y | 39 |
| zincum | kẽm | Zn | 30 |
| zirconium | zirconi | Zr | 40 |
| aurum | vàng | Au | 79 |
| ferrum | sắt | Fe | 26 |

III. Nguyên tử khối của nguyên tố hoá học
– Nguyên tử có khối lượng vô cùng bé, nếu tính bằng gam thì số trị quá nhỏ
– Khối lượng nguyên tử C bằng 1,9926.10-23 g
– Quy ước: lấy 1/12 khối lượng nguyên tử C làm đơn vị khối lượng nguyên tử gọi là đơn vị cacbon (đvC), kí hiệu là u
– Dựa theo đơn vị này để tính khối lượng nguyên tử
– Nguyên tử khối là khối lượng của một nguyên tử tính bằng đơn vị cacbon
– Có thể so sánh độ nặng nhẹ giữa các nguyên tố bằng việc lập tỉ số giữa các nguyên tử khối:
° Nếu lớn hơn 1: nặng hơn
° Nếu nhỏ hơn 1: nhẹ hơn
° Nếu bằng 1: bằng nhau
* Ví dụ: Giữa nguyên tử oxi và photpho, nguyên tử nào nhẹ hơn:
Ta lập tỉ số 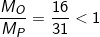 ⇒ nguyên tử oxi nhẹ hơn photpho
⇒ nguyên tử oxi nhẹ hơn photpho
– Mỗi nguyên tố đều có nguyên tử khối riêng biệt nên có thể xác định nguyên tố thông qua nguyên tử khối.
* Bảng nguyên tử khối (khối lượng nguyên tử) của các nguyên tố hóa học
| Tên Nguyên tố | Ký hiệu hoá học | Số proton | Nguyên tử khối |
| Hiđro | H | 1 | 1 |
| Heli | He | 2 | 4 |
| Liti | Li | 3 | 7 |
| Beri | Be | 4 | 9 |
| Bo | B | 5 | 11 |
| Cacbon | C | 6 | 12 |
| Nitơ | N | 7 | 14 |
| Oxi | O | 8 | 16 |
| Flo | F | 9 | 19 |
| Neon | Ne | 10 | 20 |
| Natri | Na | 11 | 23 |
| Magie | Mg | 12 | 24 |
| Nhôm | Al | 13 | 27 |
| Silic | Si | 14 | 28 |
| Photpho | P | 15 | 31 |
| Lưu huỳnh | S | 16 | 32 |
| Clo | Cl | 17 | 35,5 |
| Argon | Ar | 18 | 39,9 |
| Kali | K | 19 | 39 |
| Canxi | Ca | 20 | 40 |
| Crom | Cr | 24 | 52 |
| Mangan | Mn | 25 | 55 |
| Sắt | Fe | 26 | 56 |
| Đồng | Cu | 29 | 64 |
| Kẽm | Zn | 30 | 65 |
| Brom | Br | 35 | 80 |
| Bạc | Ag | 47 | 108 |
| Bari | Ba | 56 | 137 |
| Thuỷ ngân | Hg | 80 | 201 |
| Chì | Pb | 82 | 207 |
IV. Có bao nhiêu nguyên tố hoá học?
– Cho đến nay, đã có hơn 110 nguyên tố hóa học. Oxi là nguyên tố phổ biến nhất, chiếm gần nửa khối lượng vỏ Trái Đất.
V. Bài tập về Nguyên tố hoá học
Bài 3 trang 20 SGK hoá 8: a) Các cách viết 2C, 5O, 3Ca lần lượt chỉ ý gì?
b) Hãy dùng chữ số và kí hiệu hóa học diễn đạt các ý sau: Ba nguyên tử nitơ, bảy nguyên tử canxi, bốn nguyên tử natri.
* Lời giải bài 3 trang 20 SGK hoá 8:
a) Ý nghĩa của các cách viết:
2C ⇔ hai nguyên tử cacbon
5O ⇔ năm nguyên tử oxi
3Ca ⇔ ba nguyên tử canxi
b) Dùng ký hiêu hoá học diễn tả
ba nguyên tử nitơ ⇔ 3N
bảy nguyên tử canxi ⇔ 7Ca
bốn nguyên tử natri ⇔ 4Na
Bài 4 trang 20 SGK hoá 8: Lấy bao nhiêu phần khối lượng của nguyên tử cacbon làm đơn vị cacbon? Nguyên tử khối là gì?
* Lời giải bài 4 trang 20 SGK hoá 8:
– Lấy 1/12 khối lượng của nguyên tử cacbon làm đơn vị cacbon.
– Nguyên tử khối là khối lượng của một nguyên tử tính bằng đơn vị cacbon.
Bài 5 trang 20 SGK hoá 8: Hãy so sánh nguyên tử magie nặng hay nhẹ hơn bao nhiêu lần so với
a) nguyên tử cacbon
b) nguyên tử lưu huỳnh
c) nguyên tử nhôm
* Lời giải bài 5 trang 20 SGK hoá 8:
♦ Nguyên tử magie (Mg):
– Nặng hơn bằng 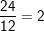 lần nguyên tử cacbon (C)
lần nguyên tử cacbon (C)
– Nhẹ hơn bằng 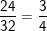 lần nguyên tử lưu huỳnh(S)
lần nguyên tử lưu huỳnh(S)
– Nhẹ hơn bằng 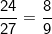 lần nguyên tử nhôm (Al)
lần nguyên tử nhôm (Al)
Bài 6 trang 20 SGK hoá 8: Nguyên tử X nặng gấp hai lần nguyên tử nitơ. Tính nguyên tử khối và cho biết X thuộc nguyên tố nào? Viết kí hiệu hóa học của nguyên tố đó.
* Lời giải bài 6 trang 20 SGK hoá 8:
– Nguyên tử khối của N = 14 đvC
⇒ Nguyên tử khối của X = 2 x 14 = 28 (đvC)
– Vậy X là nguyên tố silic (Si)
Bài 7 trang 20 SGK hoá 8: a) Theo giá trị khối lượng tính bằng gam của nguyên tử cacbon cho trong bài học, hãy tính xem một đơn vị cacbon tương ứng với bao nhiêu gam?
b) Khối lượng tính bằng gam của nguyên tử nhôm là A, B, C hay D?
A. 5,324.10-23g. B. 6,023.10-23g.
C. 4,482.10-23g. D. 3,990.10-23g.
* Lời giải bài 7 trang 20 SGK hoá 8:
a) Ta có khối lượng 1 nguyên tử C = 1,9926 . 10-23 (g) và bằng 12 đvC.
⇒ khối lượng của 1 đơn vị cacbon là: 1đvC = 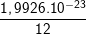 =1,66.10-24
=1,66.10-24
b) Khối lượng tính bằng gam của nguyên tử nhôm
Nhân số trị nguyên tử khối của nhôm với số gam tương ứng của một đơn vị cacbon
MAl = 27x 1,66.10-24 g = 44,82.10-24 g = 4,482.10-23 g. ⇒ Đáp án: C.4,482.10-23g.
Hy vọng với bài viết về Nguyên tố hoá học, bảng ký hiệu, nguyên tử khối và bài tập ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-8-bai-5-nguyen-to-hoa-hoc-bang-ky-hieu-nguyen-tu-khoi/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





