Hoá 9 bài 1: Tính chất hoá học của oxit, phân loại oxit và bài tập vận dụng. Ở lớp 8 các em đã được học về Oxi – không khí và được giới thiệu sơ lược về Oxit Bazo và Oxit axit, ngoài 2 loại oxit chính vừa rồi còn có những oxit nào, dựa vào tính chất hoá học nào để phân loại oxit?
Trong bài viết này chúng ta cùng tìm hiểu chi tiết về oxit là gì, tính chất hoá học của oxit axit và oxit bazơ, cách phân loại oxit.
Bạn đang xem bài: Hoá 9 bài 1: Tính chất hoá học của oxit, phân loại oxit và bài tập vận dụng
I. Oxit là gì? cách gọi tên oxit?
1. Định nghĩa Oxit
– Oxit là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi.
Ví dụ: CaO, CuO, CO2, SO2, FeO, …
2. Cách gọi tên Oxit
– Tên oxit bazơ = tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + “Oxit”
Ví dụ: Na2O: Natri Oxit; Fe2O3: Sắt (III) Oxit; FeO : Sắt (II) Oxit.
– Tên oxit axit =(Tên tiền tố chỉ số nguyên tử của phi kim) + Tên phi kim + (tên tiền tố chỉ số nguyên tử oxi) + “Oxit”
| Chỉ số | Tên Tiền tố | Ví dụ |
| 1 | Mono (không cần ghi) | CaO: Canxi Oxit |
| 2 | Đi | CO2: Cacbon đioxit |
| 3 | Tri | SO3: Lưu huỳnh trioxit |
| 4 | Tetra | |
| 5 | Penta | N2O5: Đi-nitơ penta-oxit |
| … |

II. Phân loại Oxit
– Để phân loại oxit người ta dựa vào tính chất hóa học của chúng với nước, axit, bazơ,…
– Các oxit được chia thành 4 loại:
+ Oxit bazơ: Là những oxit khi tác dụng với dung dịch axit, tạo thành muối và nước.
Ví dụ: Na2O , CuO , BaO , FeO ,…
+ Oxit axit: Là những oxit khi tác dụng với dung dịch bazơ, tạo thành muối và nước.
Ví dụ: SO2 , SO3 , CO2 , P2O5 ,…
+ Oxit lưỡng tính: Là những oxit khi tác dụng với dung dịch bazơ, và khi tác dụng với dung dịch axit tạo thành muối và nước.
Ví dụ: Al2O3 , ZnO ,…
+ Oxit trung tính: Còn được gọi là oxit không tạo muối, là những oxit không tác dụng với axit, bazơ, nước.
Ví dụ: CO , NO ,…
III. Tính chất hoá học của Oxit
1. Tính chất hoá học của Oxit Bazơ
a) Oxit bazo tác dụng với nước (Oxit bazo + H2O)
– Một số oxit bazơ tác dụng với nước ở nhiệt độ thường là : Na2O; CaO; K2O; BaO, …tạo ra bazơ tan ( kiềm) tương ứng là: NaOH, Ca(OH)2 , KOH, Ba(OH)2
– PTPƯ: Oxit bazơ + nước → Bazơ
Ví dụ: Na2O + H2O → NaOH
CaO + H2O → Ca(OH)2
BaO + H2O → Ba(OH)2
b) Oxit bazo tác dụng với axit (Oxit bazo + axit)
– Oxit bazơ tác dụng với axit tạo thành muối và nước.
– PTPƯ: Oxit bazơ + axit → muối + nước
Ví dụ: CuO + 2HCl → CuCl2 + H2O
CaO + 2HCl → CaCl2 + H2O
Na2O + H2SO4 → Na2SO4 + H2O
c) Oxit bazo tác dụng với oxit axit (Oxit bazo + oxit axit)
– Một số oxit bazơ (CaO, BaO, Na2O, K2O,…) tác dụng với oxit axit tạo thành muối.
– PTPƯ: Oxit bazơ + oxit axit → Muối
Ví dụ: Na2O + CO2 → Na2CO3
CaO + CO2 → CaCO3
BaO + CO2 → BaCO3
2. Tính chất hoá học của oxit axit
– Oxit axit ngoài cách gọi tên như trên còn có cách gọi khác là: AnHiDric của axit tương ứng.
Ví dụ: SO2: Anhidric sunfurơ (Axit tương ứng là H2SO3: axit sunfurơ)
a) Oxit axit tác dụng với nước (oxit axit + H2O)
– Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit.
– Một số oxit axit tác dụng với nước ở điều kiện thường như: P2O5 , SO2 , SO3 , NO2, N2O5 , CO2 , CrO3 ,… tạo ra axit tương ứng như: H3PO4 , H2SO3 , H2SO4 , HNO3 , H2CO3 , H2Cr2O7 ,…
Ví dụ: 2NO2 + H2O + ½O2 → 2HNO3.
CO2 + H2O → H2CO3
CrO3 + H2O → H2CrO4 → H2Cr2O7.
N2O5 + H2O → 2HNO3.
Chú ý: NO , N2O , CO không tác dụng với nước ở điều kiện thường (nhiệt độ thường).
b) Oxit axit tác dụng với bazơ (Oxit axit + bazo)
– Oxit axit tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ: CO2 + Ca(OH)2 → CaCO3 + H2O
P2O5 + NaOH → Na3PO4 + H2O
SO3 + NaOH → NaHSO4 (Muối axit)
NaHSO4 + NaOH → Na2SO4 + H2O (Muối trung hòa)
SO3 + 2NaOH → Na2SO4 + H2O
c) Oxit axit tác dụng với oxit bazơ (Oxit axit + Oxit Bazo)
– Oxit axit tác dụng với một số oxit bazơ (CaO , BaO , Na2O , K2O ,…) tạo thành muối.
Ví dụ: Na2O + SO2 → Na2SO3
CO2( k) + CaO → CaCO3
* Oxit lưỡng tính: Một số oxit vừa tác dụng dung dịch axit, vừa tác dụng với dung dịc bazơ, gọi là oxit lưỡng tính. Thí dụ như: Al2O3 , ZnO , SnO , Cr2O3 ,…
Ví dụ: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → H2O + 2NaAlO2 (natri aluminat)
* Oxit trung tính (hay là oxit không tạo muối): Một số oxit không tác dụng với axit, dung dịch, bazơ, nước, gọi là oxit trung tính như: NO , N2O , CO ,…
IV. Bài tập Oxit Axit, Oxit Bazo
Bài 1 trang 6 sgk hoá 9: Có những oxit sau: CaO, Fe2O3, SO3. Oxit nào có thể tác dụng được với:
a) Nước.
b) Axit clohiđric.
c) Natri hiđroxit.
Viết các phương trình phản ứng.
* Lời giải bài 1 trang 6 sgk hoá 9:
a) Những oxit tác dụng với nước:
CaO + H2O → Ca(OH)2
SO3 + H2O → H2SO4
b) Những oxit tác dụng với axit clohiđric:
CaO + 2HCl → CaCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
c) Những oxit tác dụng với dung dịch natri hiđroxit:
SO3 + NaOH → NaHSO4
SO3 + 2NaOH → Na2SO4 + H2O.
Bài 2 trang 6 sgk hoá 9: Có những chất sau: H2O, KOH, K2O, CO2. Hãy cho biết những cặp chất nào có thể tác dụng với nhau.
* Lời giải bài 2 trang 6 sgk hoá 9:
– Những cặp chất tác dụng với nhau từng đôi một:
H2O + CO2 → H2CO3
H2O + K2O → 2KOH
2KOH + CO2 → K2CO3 + H2O
KOH + CO2 → KHCO3
K2O + CO2 → K2CO3
Bài 3 trang 6 sgk hoá 9: Từ những chất sau: Canxi oxit, lưu huỳnh đioxit, cacbon đioxit, lưu huỳnh trioxit, kẽm oxit, em hãy chọn một chất thích hợp điền vào các phản ứng:
a) Axit sunfuric + … → kẽm sunfat + nước
b) Natri hiđroxit + … → natri sunfat + nước
c) Nước + … → axit sunfurơ
d) Nước + … → canxi hiđroxit
e) Canxi oxit + … → canxi cacbonat
Dùng các công thức hóa học để viết tất cả những phương trình phản ứng hóa học trên.
* Lời giải bài 3 trang 6 sgk hoá 9:
a) H2SO4 + ZnO → ZnSO4 + H2O
b) 2NaOH + SO3 → Na2SO4 + H2O
c) H2O + SO2 → H2SO3
d) H2O + CaO → Ca(OH)2
e) CaO + CO2 → CaCO3
Bài 4 trang 6 sgk hoá 9: Cho những oxit sau: CO2, SO2, Na2O, CaO, CuO. Hãy chọn những chất đã cho tác dụng với:
a) nước để tạo thành axit.
b) nước để tạo thành dung dịch bazơ.
c) dung dịch axit để tạo thành muối và nước.
d) dung dịch bazơ để tạo thành muối và nước.
Viết các phương trình phản ứng hóa học trên.
* Lời giải bài 4 trang 6 sgk hoá 9:
a) CO2, SO2 tác dụng với nước tạo thành axit:
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
b) Na2O, CaO tác dụng với nước tạo thành dung dịch bazơ:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
c) Na2O, CaO, CuO tác dụng với axit tạo thành muối và nước:
Na2O + 2HCl → 2NaCl + H2O
CaO + H2SO4 → CaSO4 + H2O
CuO + H2SO4 → CuSO4 + H2O
d) CO2, SO2 tác dụng với dung dịch bazơ tạo thành muối và nước:
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Bài 5 trang 6 sgk hoá 9: Có hỗn hợp khí CO2 và O2. Làm thế nào có thể thu được khí O2 từ hỗn hợp trên? Trình bày cách làm và viết phương trình phản ứng hóa học.
* Lời giải bài 5 trang 6 sgk hoá 9:
– Dẫn hỗn hợp khí CO2 và O2 đi qua bình đựng dung dịch kiềm (dư) (Ca(OH)2, NaOH…) khí CO2 bị giữ lại trong bình, do có phản ứng sau:
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Hoặc CO2 + 2NaOH → Na2CO3 + H2O
Bài 6 trang 6 sgk hoá 9: Cho 1,6g đồng (II) oxit tác dụng với 100g dung dịch axit sunfuric có nồng độ 20%.
a) Viết phương trình phản ứng hóa học.
b) Tính nồng độ phần trăm các chất có trong dung dịch sau khi phản ứng kết thúc.
* Lời giải bài 6 trang 6 sgk hoá 9:
– Theo bài ra ta có: nCuO = n/M = 1,6/80 = 0,02 (mol).
– mH2SO4 = mct/mdd = 20/100 = 20 (g). ⇒ nH2SO4 = n/M = 20/98 ≈ 0,2 (mol).
a) Phương trình phản ứng:
CuO + H2SO4 → CuSO4 + H2O
b) Theo phương trình phản ứng trên thì lượng CuO tham gia phản ứng hết, H2SO4 còn dư.
– Khối lượng CuSO4 tạo thành, tính theo số mol CuO:
nCuSO4= nCuO = 0,02 (mol) ⇒ mCuSO4 = 0,02.160 = 3,2 (g).
– Khối lượng H2SO4 dư sau phản ứng:
mH2SO4 = 20 – (98.0,02) = 18,04 (g).
– Nồng độ phần trăm các chất trong dung dịch sau phản ứng:
C%CuSO4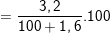 % ≈ 3,15%
% ≈ 3,15%
C%H2SO4 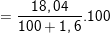 % ≈ 17,76%
% ≈ 17,76%
Hy vọng với bài viết về tính chất hoá học của oxit với 2 oxit chính là oxit bazo và oxit axit cùng cách phân loại oxit và bài tập ở trên hữu ích cho các em. Mọi góp ý hay thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/hoa-9-bai-1-tinh-chat-hoa-hoc-cua-oxit-phan-loai-oxit/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




