Hóa 9 bài 8: Một số Bazo quan trọng, tính chất hóa học của Natri Hidroxit NaOH, Canxi Hidroxit Ca(OH)2. Trong bài trước các em đã được học về tính chất hóa học của bazo, trong bài viết này chúng ta sẽ tìm hiểu về một số bazo quan trọng đó là Natri hidroxit NaOH và Canxi hidroxit Ca(OH)2
Vậy Natri hidroxit NaOH và Canxi hidroxit Ca(OH)2 có những tính chất hóa học cụ thể nào? được điều chế như thế nào và có những ứng dụng gì trong thực tế mà được gọi là một trong những bazo quan trọng, chúng ta cùng tìm hiểu qua bài 8 hóa học 9 này.
Bạn đang xem bài: Hóa 9 bài 8: Một số Bazo quan trọng, tính chất hóa học của Natri Hidroxit NaOH, Canxi Hidroxit Ca(OH)2
A. NATRI HIDROXIT – NaOH
– Công thức hóa học: NaOH
– Tên gọi: Natri hidroxit
– Khối lượng phân tử: 40
I. Tính chất vật lý của Natri hidroxit
– Là chất rắn, không màu, hút ẩm mạnh, tan nhiều trong nước.
– Dung dịch Natri hidroxit có tính nhờn làm bục vải, giấy và ăn mòn da. Vì vậy, khi sử dụng Natri hidroxit NaOH phải hết sức cẩn thận.
II. Tính chất hóa học của Natri hidroxit
– Natri hidroxit có đầy đủ tính chất hóa học của 1 bazơ
1. Làm đổi màu chất chỉ thị
– Làm quỳ tím đổi thành màu xanh.
– Làm phenolphthalein không màu đổi sang màu đỏ.
2. Natri hidroxit tác dụng với oxit axit
– PTPƯ: NaOH + Oxit axit → Muối + Nước
– Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Ví dụ: 2NaOH + CO2 → Na2CO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
NaOH + SiO2 → Na2SiO3 (*)
– Phản ứng (*) là phản ứng ăn mòn thủy tinh (NaOH ở nhiệt độ nóng chảy) vì thế khi nấu chảy NaOH, người ta dùng các dụng cụ bằng sắt, niken hay bạc mà không dùng thủy tinh để chứa NaOH.

3. Natri hidroxit tác dụng với axit
– PTPƯ: NaOH + Axit → Muối + Nước
Ví dụ: NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Natri hidroxit tác dụng với muối
– PTPƯ: NaOH + Muối → Muối mới + Bazo mới
– Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ: 2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓ nâu đỏ
3NaOH + FeCl3 → 3NaCl + Fe(OH)3 ↓
5. Dung dịch NaOH có khả năng hoà tan : Al, Al2O3 , Al(OH)3
Ví dụ: 2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3 → 2NaAlO2 + H2O
NaOH + Al(OH)3 → NaAlO2 + 2H2O
– Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng
6. Natri hidroxit tác dụng với một số phi kim như Si, C, P, S, Halogen:
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOHnóng chảy → 2Na + 2Na2CO3 + 3H2↑
4P trắng + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → NaCl + NaClO3 + 3H2O
III. Điều chế và ứng dụng của Natri hidroxit
1. Điều chế Natri hidroxit
– Phương pháp hóa học:
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
– Nếu cần một lượng nhỏ, rất tinh khiết, người ta cho kim loại kiềm tác dụng với nước:
Na + H2O → NaOH + H2↑
– Phương pháp điện phân dung dịch NaCl bão hòa (có màng ngăn):
2NaCl + 2H2O ![small xrightarrow[]{dp} 15527916500r3hzyhztm 1630714913 1630796630 1](https://tmdl.edu.vn/wp-content/uploads/2023/03/15527916500r3hzyhztm_1630714913_1630796630-1.gif) 2NaOH + Cl2↑ +H2↑
2NaOH + Cl2↑ +H2↑
2. Ứng dụng của Natri hidroxit
– Natri hidroxit được dùng để sản xuất xà phòng, giấy, tơ nhân tạo, tinh dầu thực vật và các sản phẩm chưng cất dầu mỏ, chế phẩm nhuộm và dược phẩm nhuộm.
– Natri hidroxit còn được sử dụng để làm khô khí và là thuốc thử rất thông dụng trong phòng thí nghiệm.
B. Canxi hidroxit – Ca(OH)2
– Công thức hóa học của Canxihidroxit: Ca(OH)2
– Khối lượng phân tử: 74
– Tên gọi: Canxi hidroxit
– Tên thông thường: Vôi tôi
I. Tính chất vật lý của Canxi hidroxit
-Dung dịch trong nước gọi là nước vôi trong. Nước vôi trắng là huyền phù của Ca(OH)2 trong nước. Vôi bột là Ca(OH)2 ở dạng bột.
II. Tính chất hóa học của Canxi hidroxit
– Ca(OH)2 có đầy đủ tính chất chung của một bazơ
1. Canxi hidroxit tác dụng với chất chỉ thị
– Làm quỳ tím hóa xanh
– Làm phenolphthalein không màu đổi sang màu đỏ.
2. Canxihidroxit tác dụng với axit
– PTPƯ: Ca(OH)2 + Axit → Muối + Nước
Ví dụ: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2 + 6H2O
3. Canxi hidroxit tác dụng với oxit axit
– PTPƯ: Ca(OH)2 + Oxit Axit → Muối + Nước
Ca(OH)2 + SO2 → CaSO3 + H2O
– Thổi CO2 vào nước vôi trong làm vẩn đục do tạo thành kết tủa CaCO3, tiếp tục thổi nữa thì kết tủa tan tạo thành dung dịch trong suốt:
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3 + CO2 + H2O → Ca(HCO3)2
4. Canxi hidroxit tác dụng với dung dịch muối
– PTPƯ: Ca(OH)2 + Muối → Muối mới+ Bazo mới
Ví dụ: Ca(OH)2 + Na2CO3 → CaCO3↓+ NaOH
– Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
III. Điều chế và ứng dụng của Canxi hidroxit
1. Điều chế Canxi hidroxit
CaO + H2O → Ca(OH)2
2. Ứng dụng của Canxi hidroxit
– Làm vật liệu xây dựng
– Khử chua đất trồng trọt, khử độc, khử trùng, diệt nấm
C. Thang PH biểu thị độ axit hoặc bazơ của dung dịch
• PH = 7: Dung dịch trung tính (nước cất có PH = 7)
• PH < 7: Dung dịch có tính axit, PH càng nhỏ độ axit càng lớn.
• PH > 7: Dung dịch có tính bazơ, PH càng lớn độ axit càng lớn
D. Bài tập về Natri hidroxit và Canxi hidroxit
* Bài 1 trang 7 SGK hóa 9: Có 3 lọ không nhãn, mỗi lọ đựng một chất rắn sau: NaOH, Ba(OH)2, NaCl. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học nếu có.
* Lời giải bài 1 trang 7 SGK hóa 9:
– Lấy mẫu thử từng chất và đánh số thứ tự. Hòa tan các mẫu thử vào H2O rồi thử các dung dịch:
• Dùng quỳ tím cho vào từng mẫu thử
+ Mẫu nào làm quỳ tím hóa xanh đó là NaOH và Ba(OH)2.
+ Còn lại là NaCl không có hiện tượng.
• Cho H2SO4 vào các mẫu thử NaOH và Ba(OH)2
+ Mẫu nào có kết tủa trắng đó là sản phẩm của Ba(OH)2,
PTPƯ: Ba(OH)2 + H2SO4 → BaSO4↓ trắng + 2H2O
+ Còn lại là NaOH.
* Bài 2 trang 7 SGK hóa 9: Có những chất sau: Zn, Zn(OH)2, NaOH, Fe(OH)3, CuSO4, NaCl, HCl. Hãy chọn những chất thích hợp điền vào sơ đồ phản ứng sau và lập phương trình hóa học.
a) … → Fe2O3 + H2O
b) H2SO4 + … → Na2SO4 + H2O
c) H2SO4 + … → ZnSO4 + H2O
d) NaOH + … → NaCl + H2O
e) … + CO2 → Na2CO3 + H2O.
* Lời giải bài 2 trang 7 SGK hóa 9:
a) 2Fe(OH)3 → Fe2O3 + 3H2O
b) H2SO4 + 2NaOH → Na2SO4 + 2H2O
c) H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O
d) NaOH + HCl → NaCl + H2O
e) 2NaOH + CO2 → Na2CO3 + H2O.
* Bài 3 trang 7 SGK hóa 9: Dẫn từ từ 1,568 lít khí CO2(đktc) vào một dung dịch có hòa tan 6,4g NaOH. Sản phẩm là muối Na2CO3.
a) Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
b) Hãy xác định muối thu được sau phản ứng.
* Lời giải bài 3 trang 7 SGK hóa 9:
a) Các em cần lưu ý trong bài toán tổng quát, khi CO2 phản ứng với NaOH, ta cần lập tỉ lệ như sau: 
- Nếu k ≥ 2 ⇒ Chỉ tạo muối Na2CO3; Khi k = 2 phản ứng vừa đủ, k > 2 NaOH dư
- Nếu k ≤ 1 ⇒ Chỉ tạo muối NaHCO3; Khi k = 1 phản ứng vừa đủ, k < 1 CO2 dư
- Nếu 1 < k < 2 ⇒ Tạo cả 2 muối Na2CO3 và NaHCO3
– Ở bài toán này, đề bài cho muối thu được là Na2CO3 nên NaOH chắc chắn dư. Các bước tính cụ thể như sau:
– Theo bài ra, ta có:  ;
; 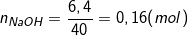
– Ta có: k=nNaOH/nCO2 > 2 nên muối sau phản ứng là Na2CO3; CO2 phản ứng hết, NaOH dư.
– Phương trình phản ứng :
2NaOH + CO2 → Na2CO3 + H2O
– Theo PTPƯ: nNaOH pư = 2.nCO2 = 2.0,07 = 0,14 (mol) ⇒ nNaOH dư = 0,16 – 0,14 = 0,02 (mol).
– Khối lượng chất dư sau phản ứng:
mNaOH = n.M = 0,02.40 = 0,8 (g).
b) Cũng theo PTPƯ trên thì: nNa2CO3 = nCO2 = 0,07 (mol)
⇒ mNa2CO3 = n.M = 0,07.106 = 7,42 (g).
* Bài 1 trang 30 SGK hóa 9: Viết các phương trình hóa học thực hiện các chuyển đổi hóa học sau:
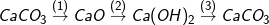

* Lời giải bài 1 trang 30 SGK hóa 9:
– Phương trình hóa học của các phản ứng:
(1) CaCO3 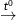 CaO + CO2↑
CaO + CO2↑
(2) CaO + H2O → Ca(OH)2
(3) Ca(OH)2 + CO2 → CaCO3 + H2O
(4) CaO + 2HCl → CaCl2 + H2O
(5) Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
* Bài 2 trang 30 SGK hóa 9: Có ba lọ không nhãn, mỗi lọ đựng một trong ba chất rắn màu trắng sau: CaCO3, Ca(OH)2, CaO. Hãy nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết phương trình hóa học.
* Lời giải bài 2 trang 30 SGK hóa 9:
– Lấy mỗi chất rắn 1 ít làm mẫu thử và đánh số thứ tự
– Cho ba chất rắn vào nước:
+ Chất nào không tan trong nước đó là CaCO3.
+ Chất nào phản ứng với nước làm nóng ống nghiệm là CaO
PTHH: CaO + H2O → Ca(OH)2
+ Chất chỉ tan 1 phần tạo chất lỏng màu trắng và có 1 phần kết tủa lắng dưới đáy là Ca(OH)2
* Bài 3 trang 30 SGK hóa 9: Hãy viết các phương trình hóa học khi cho dung dịch NaOH tác dụng với dung dịch H2SO4 tạo ra:
a) Muối natri hiđrosunfat.
b) Muối natri sunfat.
* Lời giải bài 3 trang 30 SGK hóa 9:
a) Muối natri hidrosunfat: NaHSO4
H2SO4 + NaOH → NaHSO4 + H2O
b) Muối natri sunfat: Na2SO4
H2SO4 + 2NaOH → Na2SO4 + 2H2O
* Bài 4 trang 30 SGK hóa 9: Một dung dịch bão hòa khí CO2 trong nước có pH = 4. Hãy giải thích và viết phương trình hóa học của CO2 với nước.
* Lời giải bài 4 trang 30 SGK hóa 9:
– Dung dịch bão hòa CO2 trong nước tạo ra dung dịch axit cacbonic (H2CO3) là axit yếu, có pH=4.
CO2 + H2O 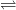 H2CO3.
H2CO3.
Hy vọng với bài viết về một số bazo quan trọng, tính chất hóa học của Natri hidroxit NaOH, Canxi hidroxit Ca(OH)2 và bài tập vận dụng ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá ghi nhận và hỗ trợ, chúc các em học tập tốt.
tmdl.edu.vn. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-9-bai-8/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục