Hóa học 10 Kết nối tri thức Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm được Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 10 Kết nối tri thức Bài 6
I. Cấu hình electron nguyên tử của các nguyên tố nhóm
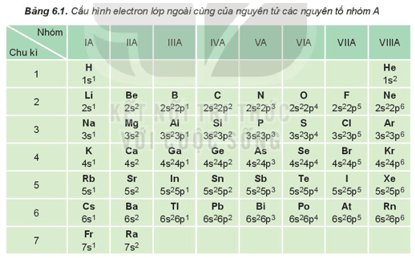
– Nhóm A gồm các nguyên tố s và p.
– Nguyên tử của các nguyên tố cùng một nhóm A có số electron lớp ngoài cùng (electron hóa trị) bằng nhau (trừ He trong nhóm VIIIA). Sự giống nhau về số electron hóa trị dẫn đến sự tương tự nhau về tính chất hóa học của các nguyên tố trong cùng nhóm A.
– Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn. Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
II. Bán kính nguyên tử
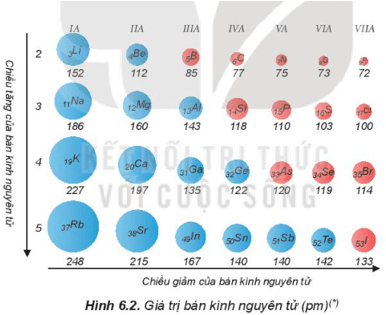
– Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại bán kính tăng là do lực hút giảm.
– Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
+ Trong một nhóm, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Chú ý:
– Năng lượng ion hóa thứ nhất của nguyên tử là năng lượng tối thiểu cần thiết để tách electron thứ nhất ra khỏi nguyên tử ở thể khí, ở trạng thái cơ bản:
X (g) → X+ (g) + e
– Năng lượng ion hóa thứ nhất kí hiệu là I1, đơn vị KJ/ mol.
III. Độ âm điện
– Độ âm điện của một nguyên tử (χ) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
– Khi tham gia liên kết hóa học, nguyên tử có độ âm điện nhỏ dễ nhường electron; nguyên tử có độ âm điện lớn dễ nhận electron.
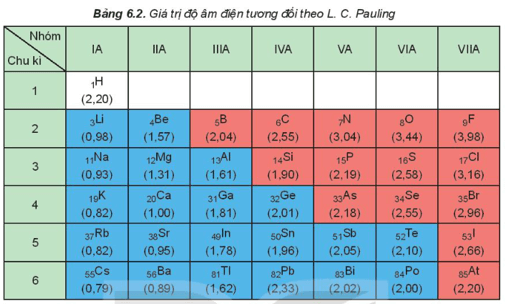
– Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
IV. Tính kim loại, tính phi kim
1. Khái niệm
– Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương.
Ví dụ: Na → Na+ + 1e
Nguyên tử càng dễ nhường electron tính kim loại càng mạnh.
– Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm.
Ví dụ: F + 1e → F–
Nguyên tử càng dễ nhận electron tính phi kim càng mạnh.
2. Sự biến đổi tính kim loại, tính phi kim
– Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với electron lớp ngoài cùng tăng. Do đó, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
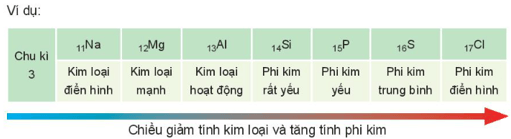
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.

Giải bài tập SGK Hóa học 10 Kết nối tri thức Bài 6
Câu hỏi 1 trang 35 Hóa học 10
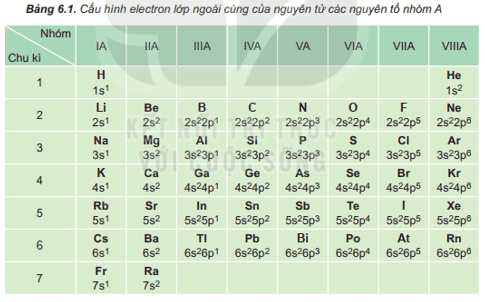
Dựa vào Bảng 6.1, cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br.
Lời giải:
Dựa vào bảng 6.1, số electron lớp ngoài cùng của nguyên tử các nguyên tố Li, Al, Ar, Ca, Si, Se, P, Br lần lượt là 1, 3, 8, 2, 4, 6, 5, 7.
Câu hỏi 2 trang 35 Hóa học 10
Nêu vị trí trong bảng tuần hoàn của các nguyên tố có Z = 8, Z = 11; Z = 17 và Z = 20. Xác định số electron hóa trị của nguyên tử các nguyên tố đó.
Lời giải:
| Ô | Chu kì | Nhóm | Số electron hóa trị | |
| Z = 8 | 8 | 2 | VIA | 6 |
| Z = 11 | 11 | 3 | IA | 1 |
| Z = 17 | 17 | 3 | VIIA | 7 |
| Z = 20 | 20 | 4 | IIA | 2 |
Chú ý:
Với các nguyên tố nhóm A, số electron hóa trị = số thứ tự của nhóm.
Câu hỏi 3 trang 36 Hóa học 10
Dựa vào bảng tuần hoàn, hãy so sánh và giải thích sự khác nhau về bán kính nguyên tử của
a) lithium (Z = 3) và potassium (Z = 19).
b) calcium (Z = 20) và selenium (Z = 34).
Lời giải:
a) Bán kính nguyên tử potassium lớn hơn bán kính nguyên tử lithium do Li và K thuộc nhóm IA, điện tích hạt nhân của potassium lớn hơn điện tích hạt nhân của lithium, nhưng Li có 2 lớp electron còn K có 4 lớp electron nên lực hút giữa hạt nhân với các electron lớp ngoài cùng của potassium nhỏ hơn.
b) Bán kính của calcium lớn hơn bán kính của selenium do Ca và Se cùng thuộc chu kì 4, lực hút giữa điện tích hạt nhân với các electron lớp ngoài cùng của Ca nhỏ hơn so với Se
Câu hỏi 4 trang 37 Hóa học 10
Dãy các nguyên tố được sắp xếp theo thứ tự độ âm điện tăng dần là Ca, Mg, P, S. Hãy giải thích sự sắp xếp này dựa trên sự biến đổi độ âm điện theo chu kì và nhóm A.
Lời giải:
– Nguyên tố Mg và Ca cùng thuộc nhóm IIA. Trong một nhóm, theo chiều tăng của điện tích hạt nhân độ âm điện giảm dần nên độ âm điện của Mg > Ca.
– Ba nguyên tố Mg, P, S cùng thuộc chu kì 3. Trong một chu kì, theo chiều tăng của điện tích hạt nhân độ âm điện tăng dần nên độ âm điện của Mg < P < S.
⇒ Thứ tự độ âm điện tăng dần là Ca, Mg, P, S.
Câu hỏi 5 trang 37 Hóa học 10
Almelec là hợp kim của aluminium với một lượng nhỏ magnesium và silicon (98,8% aluminium; 0,7% magnesium và 0,5% silicon). Almelec được sử dụng làm dây dẫn điện cao thế do nhẹ, dẫn nhiệt tốt và bền. Dựa vào bảng tuần hoàn các nguyên tố hóa học, hãy:
a) Sắp xếp theo thứ tự tăng dần về bán kính nguyên tử của các nguyên tố hóa học trong almelec.
b) Cho biết thứ tự giảm dần về độ âm điện của các nguyên tố hóa học có trong almelec.
Lời giải:
a) Các nguyên tố hóa học trong almelec là Al, Mg, Si.
Ba nguyên tố này đều thuộc chu kì 3, theo thứ tự điện tích tăng dần Mg (Z = 12), Al (Z = 13), Si (Z = 14) thì bán kính nguyên tử giảm từ Mg > Al > Si vì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
⇒ Thứ tự tăng dần về bán kính nguyên tử là Si < Al < Mg.
b) Ba nguyên tố này đều thuộc chu kì 3, theo thứ tự điện tích tăng dần Mg (Z = 12), Al (Z = 13), Si (Z = 14) thì độ âm điện tăng từ Mg < Al < Si vì khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng dẫn đến lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
⇒ Thứ tự độ âm điện giảm dần là Si > Al > Mg.
Câu hỏi 6 trang 39 Hóa học 10
Dựa vào bảng tuần hoàn các nguyên tố hóa học, sắp xếp các nguyên tố Ba, Mg, Ca, Sr theo thứ tự giảm dần tính kim loại và giải thích.
Lời giải:
Dựa vào bảng tuần hoàn, ta nhận thấy 4 nguyên tố này thuộc nhóm IIA, theo chiều tăng dần điện tích hạt nhân Mg (Z = 12), Ca (Z = 20), Sr (Z = 38), Ba (Z = 56) thì tính kim loại tăng dần.
⇒ Thứ tự giảm dần tính kim loại là Ba, Sr, Ca, Mg.
Giải thích: Từ Mg đến Ba tuy điện tích hạt nhân tăng dần, nhưng bán kính nguyên tử tăng nhanh làm cho lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm dẫn đến khả năng nhường electron tăng nên tính kim loại tăng. Vậy chiều giảm dần tính kim loại là từ Ba đến Mg.
Câu hỏi 7 trang 39 Hóa học 10
Trong các nguyên tố O, F, Cl, Se, nguyên tố có tính phi kim mạnh nhất là
A. O.
B. F.
C. Se.
D. Cl.
Lời giải:
Đáp án B
– Trong một nhóm, tính phi kim giảm dần theo chiều tăng của điện tích hạt nhân.
F (Z = 9) và Cl (Z = 17) đều thuộc nhóm VIIA nên tính phi kim của F > Cl.
O (Z = 8) và Se (Z = 34) đều thuộc nhóm VIA nên tính phi kim của O > Se.
– Trong một chu kì, tính phi kim tăng dần theo chiều tăng của điện tích hạt nhân.
O (Z = 8) và F (Z =9) đều thuộc chu kì 2 nên tính phi kim của F > O.
Lưu ý: F là phi kim mạnh nhất.
Trắc nghiệm Hóa 10 Kết nối tri thức Bài 6 (có đáp án)
Câu 1. Nhóm A gồm các nguyên tố nào?
A. Nguyên tố s;
B. Nguyên tố p;
C. Nguyên tố s và p;
D. Nguyên tố d.
Lời giải
Đáp án đúng là: C
Nhóm A gồm các nguyên tố s và p.
Câu 2. Yếu tố nào ảnh hưởng nhiều nhất đến tính chất hóa học của nguyên tố nhóm A?
A. Cấu hình electron nguyên tử;
B. Số khối;
C. Khối lượng nguyên tử.
D. Số neutron.
Lời giải
Đáp án đúng là: A
Nguyên tử của các nguyên tố cùng một nhóm A có số electron lớp ngoài cùng bằng nhau (trừ He trong nhóm VIIIA). Sự giống nhau về số electron hóa trị dẫn đến sự tương tự nhau về tính chất hóa học của các nguyên tố trong cùng nhóm A.
Câu 3. Khi xếp theo chiều tăng dần của điện tích hạt nhân, đại lượng nào sau đây không biến đổi tuần hoàn?
A. Bán kính nguyên tử;
B. Số neutron;
C. Tính kim loại, tính phi kim;
D. Độ âm điện.
Lời giải
Đáp án đúng là: B
Khi xếp theo chiều tăng dần của điện tích hạt nhân, số neutron không biến đổi tuần hoàn.
– Trong một chu kì:
+ Bán kính nguyên tử giảm dần, độ âm điện tăng dần.
+ Tính kim loại giảm dần và tính phi kim tăng dần
– Trong một nhóm A:
+ Bán kính nguyên tử tăng dần, độ âm điện giảm dần.
+ Tính kim loại tăng dần và tính phi kim giảm dần.
Câu 4. Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần của bán kính nguyên tử?
A. Li, Na, K, Rb;
B. Ca, Mg, Al, P;
C. Cl, S, O, N;
D. Br, I, Ca, Al.
Lời giải
Đáp án đúng là: A
Li, Na, K, Rb đều thuộc nhóm IA.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Câu 5. Bán kính nguyên tử phụ thuộc vào yếu tố nào?
A. Cấu hình electron nguyên tử;
B. Khối lượng nguyên tử.
C. Năng lượng ion hóa;
D. Lực hút giữa hạt nhân với các electron lớp ngoài cùng.
Lời giải
Đáp án đúng là: D
Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng là do lực hút giảm.
Câu 6. Dãy nguyên tố nào sau đây sắp xếp theo chiều giảm dần của bán kính nguyên tử?
A. S, P, Cl, O;
B. Ca, Mg, K, Br;
C. Mg, Al, P, S;
D. Na, Mg, K, Ca.
Lời giải
Đáp án đúng là: C
Mg, Al, P, S đều thuộc chu kì 3.
Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
Câu 7. Phát biểu nào sau đây không đúng về năng lượng ion hóa thứ nhất?
A. Năng lượng ion hóa thứ nhất của nguyên tử là năng lượng tối thiểu cần thiết để tách electron thứ nhất ra khỏi nguyên tử ở thế khí;
B. Năng lượng ion hóa thứ nhất kí hiệu là I1, đơn vị là kJ.mol;
C. Trong một chu kì, năng lượng ion hóa thứ nhất có xu hướng tăng theo chiều tăng dần của điện tích hạt nhân.
D. Trong một nhóm A, năng lượng ion hóa thứ nhất có xu hướng giảm theo chiều tăng dần của điện tích hạt nhân.
Lời giải
Đáp án đúng là: B
Năng lượng ion hóa thứ nhất kí hiệu là I1, đơn vị là kJ/mol.
Câu 8. Đại lượng nào đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học?
A. Bán kính nguyên tử;
B. Cấu hình electron nguyên tử;
C. Năng lượng ion hóa;
D. Độ âm điện.
Lời giải
Đáp án đúng là: D
Độ âm điện của nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
Khi tham gia liên kết hóa học, nguyên tử có độ âm điện nhỏ dễ nhường electron, nguyên tử có độ âm điện lớn dễ nhận electron.
Câu 9. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. Bán kính giảm dần, tính kim loại giảm;
B. Bán kính tăng dần, tính kim loại tăng;
C. Bán kính tăng dần, tính phi kim tăng;
D. Bán kính giảm dần, tính phi kim giảm.
Lời giải
Đáp án đúng là: A
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính giảm dần, tính kim loại giảm và tính phi kim tăng dần.
Câu 10. Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân
A. Bán kính giảm dần, tính kim loại giảm;
B. Bán kính tăng dần, tính kim loại tăng;
C. Bán kính tăng dần, tính phi kim tăng;
D. Bán kính giảm dần, tính phi kim giảm.
Lời giải
Đáp án đúng là: B
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân bán kính tăng dần, tính kim loại tăng và tính phi kim giảm dần.
Câu 11. Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần độ âm điện?
A. Na, K, Rb, Li;
B. Li, Rb, Na, K;
C. Rb, K, Na, Li;
D. Na, Li, K, Rb.
Lời giải
Đáp án đúng là: C
Li, Na, K, Rb đều thuộc nhóm IA nên độ âm điện của Rb < K < Na < Li.
Câu 12. Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần tính kim loại?
A. F, Be, N, O;
B. O, N, Be, F;
C. F, O, N, Be;
D. F, Be, O, N.
Lời giải
Đáp án đúng là: C
O, N, Be, F đều thuộc chu kì 2 nên tính kim loại của Be > N > O > F.
Câu 13. Nguyên tử nguyên tố nào sau đây có bán kính nhỏ nhất?
A. Li;
B. Na;
C. K;
D. Cs.
Lời giải
Đáp án đúng là: A
Li, Na, K, Cs đều thuộc nhóm IA nên Li có bán kính nhỏ nhất.
Câu 14. Chỉ ra nội dung sai: Tính phi kim của nguyên tố càng mạnh thì?
A. Khả năng nhận electron càng mạnh;
B. Độ âm điện càng lớn;
C. Bán kính nguyên tử càng lớn;
D. Tính kim loại càng yếu.
Lời giải
Đáp án đúng là: C
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng dẫn đến khả năng nhường electron giảm, khả năng nhận electron tăng nên tính phi kim tăng.
Câu 15. Cho các phát biểu sau:
(1) F là phi kim mạnh nhất;
(2) Li có độ âm điện nhỏ nhất;
(3) H có bán kính nguyên tử nhỏ nhất;
(4) P là phi kim hoạt động mạnh nhất.
Số phát biểu đúng là?
A. 1;
B. 2;
C. 3;
D. 4.
Lời giải
Đáp án đúng là: A
Chỉ có phát biểu (1) đúng.
******************
Trên đây là nội dung bài học Hóa học 10 Kết nối tri thức Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm do Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá
Chuyên mục: Hoá học 10
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/hoa-hoc-10-ket-noi-tri-thuc-bai-6-xu-huong-bien-doi-mot-so-tinh-chat-cua-nguyen-tu-cac-nguyen-to-trong-mot-nhom/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục