Hóa học 11 Bài 20: Mở đầu về hóa học hữu cơ được Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 20
Hợp chất hữu cơ và hóa học hữu cơ
1. Khái niệm
– Hợp chất hữu cơ là các hợp chất của C trừ oxit của C, muối cacbua, muối cacbonat, muối xianua.
– Hoá học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ.
2. Phân loại hợp chất hữu cơ.
Hợp chất hữu cơ được chia thành hidrcacbon và dẫn xuất hidrcacbon.
a/ Hidrcacbon là loại hợp chất hữu cơ đơn giản nhất, trong thành phần phân tử chỉ chứa hai nguyên tố là cacbon và hidro.
– Hidrocacbon mạch hở:
+ Hidrocacbon no: Ankan CH4
+ Hidrocacbon không no có một nối đôi: Anken C2H4
+ Hidrcacbon không no có hai nối đôi: Ankadien
– Hidrocacbon mạch vòng:
+ Hidrocacbon no: xicloankan
+ Hidrocacbon mạch vòng: Aren
b/ Dẫn xuất của hidrocacbon là những hợp chất mà trong phân tử ngoài C, H ra còn có một số hay nhiều nguyên tố khác như O, N, S, halogen…
– Dẫn xuất halogen: R – X ( R là gốc hidrocacbon)
– Hợp chất chứa nhóm chức: – OH – : ancol; – O – : ete; – COOH: axit……
3/ Đặc điểm chung
– Hợp chất hữu cơ nhất thiết phải chứa C, hay có H thường gặp O ngoài ra còn có halogen, N, P…
– Liên kết chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
– Các hợp chất hữu cơ thường dễ bay hơi, dễ cháy, kém bền nhiệt.
– Các phản ứng trong hoá học hữu cơ thường chậm, không hoàn toàn, xảy ra theo nhiều hướng thường phải đun nóng và có xúc tác.
4/ Các phương pháp tinh chế hợp chất hữu cơ
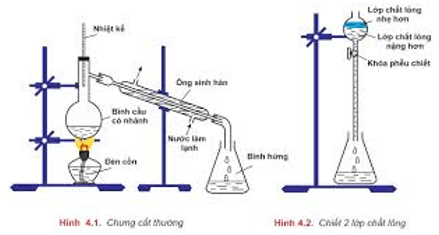
– Chưng cất: để tách các chất lỏng có nhiệt độ sôi khác nhau nhiều.
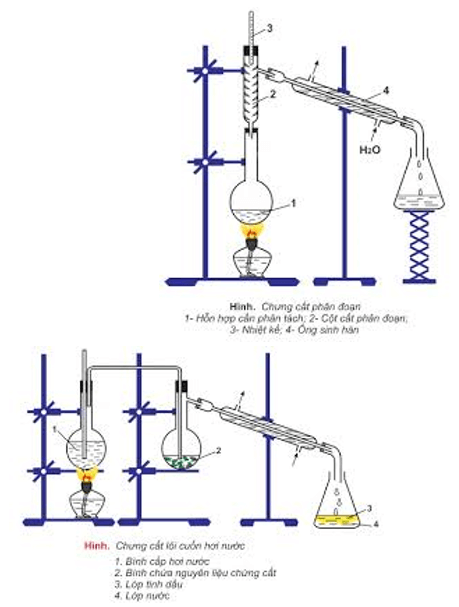
– Chiết: để tách hai chất lỏng không trộn lẫn vào nhau.
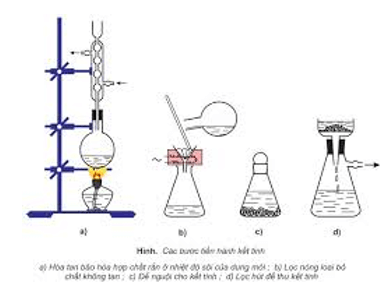
– Kết tinh lại: để tách các chất rắn có độ tan khác nhau theo nhiệt độ.
Phân tích nguyên tố
Để xác định công thức phân tử hợp chất hữu cơ người ta phải xác định :
– Thành phần định tính nguyên tố.
– Thành phần định lượng nguyên tố.
– Xác định khối lượng phân tử.
1. Phân tích định tính nguyên tố.
– Phân tích định tính nguyên tố để xác định thành phần các nguyên tố hóa học chứa trong một chất.
– Muốn xác định thành phần các nguyên tố , người ta chuyển các nguyên tồ trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản rồi nhận ra các sản phẩm đó.
a. Xác định cacbon và hidro.
– Nhận Cacbon: Đốt cháy hợp chất hữu cơ:
C −+O2→ CO2 −+Ca(OH)2→ CaCO3
– Nhận Hidro: Đốt cháy hợp chất hữu cơ:
2H −+O2→ H2O −+CuSO4 khan→ CuSO4.5H2O ( màu xanh lam)
– Hoặc có thể dùng chất hút nước mạnh như : H2SO4 đđ, CaCl2 khan, P2O5.
b. Xác định nitơ và oxi.
– Nhận N: Đốt cháy hợp chất hữu cơ, nếu có mùi khét thì hợp chất đó có nitơ.
Hoặc đun hợp chất hữu cơ với H2SO4 đặc ( NaOH đặc) có mùi khai NH3 thì hợp chất đó có chứa nitơ.
CxHyOzNt −+ H2SO4đ, tº→ (NH4)2SO4+……
(NH4)2SO4 + 2NaOH −tº→ Na2SO4 + H2O + NH3↑
– Nhận O : Khó phân tích định tính trực tiếp, thường xác định nhờ định lượng:
mO = mhợp chất – tổng khối lượng các nguyên tố
c. Xác định halogen.
Khi đốt cháy hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng HCl, ta dùng dung dịch AgNO3
HCl + AgNO3 → AgCl↓ + HNO3
2. Phân tích định lượng các nguyên tố:
– Phân tích định lượng các nguyên tố xác định khối lượng của mỗi nguyên tố hóa học chứa trong hợp chất hữu cơ.
– Muốn định lượng nguyên tố, người ta chuyển các nguyên tố trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản, định lượng chúng, từ đó suy ra khối lượng từng nguyên tố có trong một chất.
a. Định lượng cacbon và hidro.
VD: Đốt cháy chất hữu cơ A thu được CO2 và H2O và N2
mC (A) = mC(CO2) = nCO2.12
mH(A) = mH(H2O) = nH2O.2
b. Định lượng nitơ
mN(A) = nN2.28
c. Định lượng oxi
mO = m(A) – ( mC + mH + mN ).
* Chú ý :
– Dùng H2SO4 đặc, P2O5, CaCl2 khan hấp thụ H2O.
– Dùng NaOH, KOH, Ca(OH)2 hấp thụ CO2, độ tăng khối lượng của bình hay khối lượng kết tủa CaCO3 giúp ta tính được CO2
– Chỉ dùng CaO, Ca(OH)2, NaOH hấp thụ sản phẩm gồm CO2 và H2O thì khối lượng bình tăng chính là tổng khối lượng CO2 và H2O.
3. Thành phần nguyên tố:
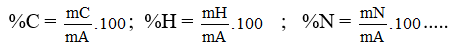
Giải bài tập SGK Hóa học 11 Bài 20
Bài 1 (trang 91 SGK Hóa 11)
So sánh hợp chất vô cơ và hợp chất hữu cơ về: thành phần nguyên tố, đặc điểm liên kết hoá học trong phân tử
Lời giải:
Thành phần nguyên tố:
| Hợp chất hữu cơ | Hợp chất vô cơ |
| – Là những hợp chất có chứa nguyên tố cacbon(trừ CO, O2, muối cacbonat, xianiua, cacbua…) | – Là những chất có thể có cacbon, có thể không hợp chất vô cơ chứa cacbon CO, CO2, muối cacbonat, xianiua, cacbua… |
Đặc điểm liên kết hoá học trong phân tử:
| Hợp chất hữu cơ | Hợp chất vô cơ |
| – Được cấu tạo chủ yếu từ các nguên tố phi kim có độ âm điện khác nhau không nhiều. Thí dụ hay gặp nhất ngoài C là H, O, halogen, S, P…
– Liên kết trong hợp chất chủ yếu là liên kết cộng hoá trị. |
– Được cấu tạo chủ yếu từ các nguyên tố kim loại với phi kim. Ví dụ: NaCl, Mg(NO3)2…
– Liên kết trong hợp chất chủ yếu là liên kết ion. |
Bài 2 (trang 91 SGK Hóa 11)
Nếu mục đích và phương pháp tiến hành phân tích định tính và định lượng nguyên tố
Lời giải:
| Phân tích định tính | Phân tích định lượng |
| a/ Mục đích | |
| – Xác định nguyên tố nào có trong thành phần phân tử hợp chất hữu cơ | – Không những xác định được các nguyên tố nào có trong thành phần hợp chất hữu cơ mà còn xác định được thành phần phần trăm về khối lượng của các nguyên tố đó. |
| b/ Phương pháp tiến hành | |
| – Tìm C và H người ta nung hợp chất hữu cơ với CuO để chuyển C thành CO2, H thành H2O. | – Nung hợp chất hữu cơ với CuO. Hấp thụ nước bằng H2SO4 đặc, hấp thụ CO2 bằng KOH. Khối lượng tăng mỗi bình chính là khối lượng H2O và CO2 |
| – Chuyển N trong hợp chất hữu cơ thành NH3 | – Khối lượng khí N2 sinh ra thường được quy về đktc và tính |
| – Rồi nhận biết các hợp chất vô cơ đơn giản và quen thuộc trên. | – Từ đó tính được khối lượng C, H, N và phần trăm của chúng trong hợp chất |
| – Phầm trăm oxi được tính gián tiếp theo các chất đã tính được. | |
Bài 3 (trang 91 SGK Hóa 11)
Oxi hoá hoàn toàn 0,6 gam hợp chất hữu cơ A thu được 0,672 lít CO2 (đktc) và 0,72 gam H2O. Tính thành phần phần trăm khối lượng của các nguyên tố trong phân tử chất A.
Lời giải:
Gọi CTPT của hợp chất hữu cơ là CxHyOz (x, y, z nguyên dương; z ≥ 0)
Ta có:
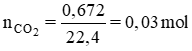
BT nguyên tố ⇒ nC = nCO2 = 0,03 mol ⇒ mC = 12. 0,03 = 0,36g
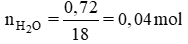
BT nguyên tố ⇒ nH = 2.nH2O = 2. 0,04 = 0,08 mol ⇒ mH = 0,08. 1 = 0,08 g
mO = 0,6 – 0,36 – 0,08 = 0,16(g)
⇒ Hợp chất A có chứa C, H, O
Phần trăm khối lượng các nguyên tố trong phân tử A là:

Bài 4 (trang 91 SGK Hóa 11)
β-Caroten (chất hữu cơ có trong củ cà rốt) có màu da cam. Nhờ tác dụng của enzim ruốt non,β-Croten chuyển thành vitamin A nên nó còn được gọi là tiến vitamin A. Oxi hoá hoàn toàn 0,67 gam β-Caroten rồi dẫn sản pẩm oxi hoá qua bình (1) đựng dung dịch H2SO4 đặc, sau đó qua bình (2) đựng dung dịch Ca(OH)2 dư. Kết quả cho thấy khối lượng bình (1) tăng 0,63 gam; bình (2) có 5 gam kết tủa. Tính phần trăm khối lượng của các nguyên tố trong phân tử β-Caroten
Lời giải:
Ca(OH)2 + CO2 → CaCO3 + H2O
Khối lượng bình (1) tăng là khối lượng của H2O = 0,63(g)
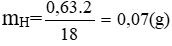
mCaCO3 = 5g ⇒ nCO2 = nCaCO3 = 5/100 = 0,05 mol
BT nguyên tố ⇒ nC = nCO2 = 0,05 mol ⇒ mC = 12. 0,05 = 0,6 g
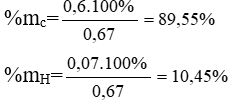
%mO = 100% – (89,55 + 10,45)% = 0%
Trắc nghiệm Hóa học 11 Bài 20 có đáp án
Bài 1: Mục đích của phân tích định lượng chất hữu cơ.
A. xác định nhiệt độ sôi của chất hữu cơ.
B. xác định phần trăm khối lượng các nguyên tố trong phân tử chất hữu cơ.
C. xác định cấu tạo của chất hữu cơ.
D. xác định các nguyên tố trong phân tử chất hữu cơ.
Lời giải
Đáp án: B
Bài 2: Oxi hóa hoàn toàn 6 gam chất hữu cơ X, thu được 6,72 lít CO2 (đktc) và 7,2 gam H2O. Khối lượng nguyên tố oxi trong 6 gam X là
A. 2,4 gam.
B. 1,6 gam.
C. 3,2 gam
D. 2,0 gam.
Lời giải
Đáp án: B
nCO2 = 0,3 mol; nH2O = 0,4 mol
mX = mC + mH + mO = 12nCO2 + 2nH2O + mO
⇒ 12.0,3 + 2.0,4 + mO = 6 ⇒ mO = 1,6 gam
Bài 3: Oxi hóa hoàn toàn 1,5 gam hợp chất hữu cơ X, thu được 0,224 lít N2 và 0,896 lít CO2 (các khí đều đo ở đktc) và 0,9 gam H2O. Khối lượng nguyên tố oxi trong 1,5 gam X là
A. 0,32 gam
B. 0,16 gam
C. 0,64 gam
D. 0,78
Lời giải
Đáp án: C
nN = 2nN2 = 0,02 ⇒ mN = 0,28
nC = nCO2 = 0,04 ⇒ mC = 0,48
nH = 2nH2O = 0,1 ⇒ mH = 0,1
⇒ mO = 1,5 – mN – mC – mH = 0,64
Bài 4: Đốt chấy hoàn toàn 8,2 gam hợp chất hữu cơ X, thu được 3,36 lít CO2 (đktc), 5,3 gam Na2CO3 và 2,7 gam H2O. Khối lượng nguyên tố oxi trong 8,2 gam X là
A. 6,1 gam.
B. 3,8 gam.
C. 5,5 gam.
D. 3,2 gam.
Lời giải
Đáp án: D
nC = nCO2 + nNa2CO3 = 0,15 + 0,05 = 0,2 ⇒ mC = 2,4
nH = 2nH2O = 0,3 ⇒ mH = 0,3
nNa = 2nNa2CO3 = 0,1 ⇒ mNa = 2,3
⇒ mO = mX – mNa – mC – mH = 3,2 gam
Bài 5: Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X (C, H, O). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đụng dung dịch KOH dư, sau thí nghiệm, khối lượng bình (1) tăng 7,2 gam, khối lượng bình (2) tăng 17,6 gam. Thành phần phần trăm khối lượng oxi trong X là
A. 36,36%
B. 27,27%
C. 40,91%
D. 54,54%.
Lời giải
Đáp án: A
mbình (1) tăng = mH2O = 7,2 gam ⇒ mH = 0,8 gam
mbình (2) tăng = mCO2 = 17,6 ⇒ mC = 4,8 gam
⇒ mO = mX – mO – mC = 3,2 gam ⇒ %mO = 36,36%
Bài 6: Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X (C, H, O). Dẫn sản phẩm chảy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đựng dung dịch Ca(OH)2 dư, sau thí nghiệm, khối lượng bình (1) tăng 5,4 gam, ở bình (2) có 30 gam kết tủa. Thành phần phần trăm khối lượng oxi trong X là
A. 16,62%
B. 45,95%
C. 28,85 %
D. 43,24%.
Lời giải
Đáp án: D
mbình (1) tăng = mH2O = 5,4 gam ⇒ mH = 0,6 g
n↓ = nCaCO3 = nCO2 = 0,3 mol ⇒ mC = 3,6 g
⇒ mO = mX – mC – mH = 3,2 g ⇒ %mO = 43,24%
Bài 7: Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ X (C, H, O). Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư. Sau thí nghiệm, thu được 10 gam kết tủa và khối lượng dung dịch giảm 3,8 gam so với dung dịch Ca(OH)2 ban đầu. Thành phần phần trăm khối lượng oxi trong X là
A. 26,67%
B. 56,67%
C. 53,33 %
D. 37,04%.
Lời giải
Đáp án: C
nCaCO3 = nCO2 = 0,1 mol ⇒ mC = 1,2g
mdung dịch giảm = m↓ – (mCO2 + mH2O) ⇒ mCO2 + mH2O = 10 – 3,8 = 6,2g
⇒ mH2O = 6,2 – 0,1.44 = 1,8g ⇒ mH = 0,2 g
⇒ mO = mX – mH – mC = 1,6g ⇒ %mO = 53,33%
Bài 8: Đốt cháy hoàn toàn 4 gam hiđrocacbon X. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2. Sau thí nghiệm, thu được 25 gam kết tủa và khối lượng dung dịch giảm 8,2 gam so với dung dịch Ca(OH)2 ban đầu. Thành phần phần trăm khối lượng cacbon trong X là
A. 75%
B. 60%
C. 80 %
D. 90%.
Lời giải
Đáp án: D
mdung dịch giảm = m↓ – (mCO2 + mH2O)
⇒ mCO2 + mH2O = 16,8 gam
Gọi nCO2 = x mol; nH2O = y mol
⇒ 44x + 18y = 16,8 (1)
mX = mC + mH = 12x + 2y = 4 (2)
Từ (1)(2) ⇒ x = 0,3; y = 0,2
⇒ %mC = [(0,3.12) / 4]. 100% = 90%
Bài 9: Đốt cháy hoàn toàn m gam hợp chất hữu cơ X (C, H, O). Cần vừa đủ 6,72 lít O2 (đktc), thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Thành phần phần trăm khối lượng oxi trong X là
A. 34,78%
B. 69,56%
C. 76,19 %
D. 67,71%
Lời giải
Đáp án: A
nO2 = 0,3 mol
Bảo toàn khối lượng:
mX + mO2 = mCO2 + mH2O
⇒ m = 4,6 gam
mC = 2,4; mH = 0,6 ⇒ mO = 1,6
⇒ %mO = 34,78%
Bài 10: Đốt cháy hoàn toàn m gam hợp chất hữu cơ X (C, H, O). Cần vừa đủ 7,84 lít O2 (đktc), thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Thành phần phần trăm khối lượng oxi trong X là
A. 16,62%
B. 45,95%
C. 28,85 %
D. 43,24%.
Lời giải
Đáp án: D
%mO = 43,24%
Bài 11: Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố
A. cacbon
B. hiđro
C. oxi
D. nitơ.
Lời giải
Đáp án: A
Bài 12: Chất nào sau đây thuộc loại chất hữu cơ?
A. Al2C4
B. CH4
C. CO
D. Na2CO3.
Lời giải
Đáp án: B
Bài 13: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. cộng hóa trị
B. ion
C. kim loại
D. hiđro.
Lời giải
Đáp án: A
Bài 14: Phản ứng hóa học của các chất hữu cơ thường
A. xảy ra nhanh và tạo ra hỗn hợp sản phẩm.
B. xảy ra chậm và tạo ra một sản phẩm duy nhất.
C. xảy ra chậm và tạo ra hỗn hợp sản phẩm.
D. xảy ra nhanh và tạo ra một sản phẩm duy nhất.
Lời giải
Đáp án: C
Bài 15: Đặc điểm chung của hợp chất hữu cơ là
A. tan trong nước, không tan trong dung môi hữu cơ.
B. nhiêt độ nóng chảy, nhiệt độ sôi cao.
C. liên kết trong phân tử chủ yếu là liên kết ion.
D. thường kém bền với nhiệt và dễ cháy.
Lời giải
Đáp án: D
Bài 16: Mục đích phân tích định tính chất hữu cơ là
A. Tan trong nước, không tan trong dung môi hữu cơ.
B. Nhiệt độ nóng chảy, nhiệt độ sôi cao.
C. Xác định phân tử khối của chất hữu cơ.
D. Xác định các nguyên tố trong phân tử chất hữu cơ.
Lời giải
Đáp án: D
******************
Trên đây là nội dung bài học Hóa học 11 Bài 20: Mở đầu về hóa học hữu cơ do Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Mở đầu về hóa học hữu cơ. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá
Chuyên mục: Hoá học 11
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/hoa-hoc-11-bai-20-mo-dau-ve-hoa-hoc-huu-co/





