Hóa học 8 Bài 23: Bài luyện tập 4 được Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Giải bài tập SGK Hóa học 8 Bài 23
Bài 1 (trang 79 SGK Hóa 8)
Hãy tìm công thức hóa học đơn giản nhất của một loại oxit của lưu huỳnh, biết rằng trong oxit này có 2g lưu huỳnh kết hợp với 3g oxi.
Bạn đang xem bài: Hóa học 8 Bài 23: Bài luyện tập 4 – Giải bài tập SGK Hóa học 8 Bài 23
Lời giải:
Số mol của nguyên tử lưu huỳnh là: 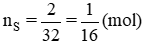
Số mol của nguyên tử oxi là: 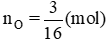
Ta có: 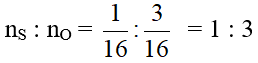
⇒ Trong một phân tử lưu huỳnh trioxit có 1 nguyên tử S và có 3 nguyên tử O.
Vậy công thức hóa học đơn giản nhất của oxit lưu huỳnh là SO3.
Bài 2 (trang 79 SGK Hóa 8)
Hãy tìm công thức hóa học của một hợp chất có thành phần theo khối lượng là 36,8% Fe; 21,0% S; 42,2% O. Biết khối lượng mol của hợp chất bằng 152 g/mol.
Lời giải:
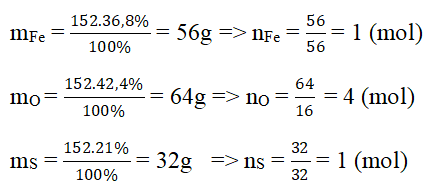
Vậy trong 1 phân tử hợp chất có 1 nguyên tử Fe, 4 nguyên tử O, 1 nguyên tử S.
⇒ CTHH là FeSO4.
Bài 3 (trang 79 SGK Hóa 8)
Một hợp chất có công thức hóa học là K2CO3. Em hãy cho biết:
a) Khối lượng mol của chất đã cho.
b) Thành phần phần trăm (theo khối lượng) của các nguyên tố có trong hợp chất.
Lời giải:
a) MK2CO3 = 39.2 + 12 + 16.3 = 138 (g)
b)
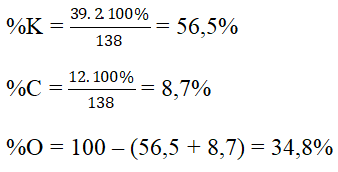
Bài 4 (trang 79 SGK Hóa 8)
Có phương trình hóa học sau:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
a) Tính khối lượng canxi clorua thu được khi cho 10g canxi cacbonat tác dụng với axit clohiđric dư.
b) Tính thể tích khí cacbonic thu được trong phòng thí nghiệm, nếu có 5g canxi cacbonat tác dụng hết với axit. Biết 1 mol khí ở điều kiện phòng có thể tích là 24 lít.
Lời giải:
a) Số mol canxi cacbonat tham gia phản ứng nCaCO3= 10/100 = 0,1 mol.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
Theo phương trình hóa học, ta có: nCaCl2= nCaCO3 = 0,1 mol.
Khối lượng của canxi clorua tham gia phản ứng: mCaCl2 = 0,1 . (40 + 71) = 11,1 g.
b) Số mol canxi cacbonat tham gia phản ứng: nCaCO3= 5/100 = 0,05 mol.
Theo phương trình hóa học, ta có: nCO2= nCaCO3 = 0,05 mol.
Thể tích khí CO2 ở điều kiện phòng là: VCO2 = 24 . 0,05 = 1,2 lít.
Bài 5 (trang 79 SGK Hóa 8)
Khí metan CH4 có trong khí tự nhiên hoặc trong khí bioga. Khí metan cháy trong không khí sinh ra khí cacbon đioxit và nước:
CH4 + 2O2 → CO2 + 2H2O.
a) Tính thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2 khí metan. Các thể tích khí đo cùng điều kiện to và p.
b) Tính thể tích khí CO2 (đktc) thu được sau khi đốt cháy hoàn toàn 0,15 mol khí metan.
c) Khí metan nặng hay nhẹ hơn không khí bằng bao nhiêu lần?
Lời giải:
a) Theo phương trình hóa học, ta thấy nếu đốt cháy hết 1 mol phân tử khí CH4 thì phải cần 2 mol phân tử khí O2. Do đó thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2 lít khí metan là:
VO2 = 2 . 2 = 4 lít.
b) Theo phương trình phản ứng, khi đốt cháy hoàn toàn 0,15 mol khí metan thì cũng sinh ra 0,15 mol khí cacbon đioxit. Do đó thể tích khí CO2 thu được là:
VCO2 = 0,15 . 22,4 = 3,36 lít.
c) Tỉ khối của khí metan và không khí là:
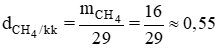
Vậy khí metan nhẹ hơn không khí 0,55.
Trắc nghiệm Hóa học 8 Bài 23 (có đáp án)
Câu 1: 0,5 mol mol nước chứa số nguyên tử
A. 3,01.1023
B. 6,02.1023
C. 3.1023
D. 4.1023
Đáp án: A
Số ng.tử = số mol . số Avogadro = 0,5.6,2.1023 = 3,2.1023
Câu 2: Số mol phân tử Cl2 có trong 7,1 g Cl2
A. 1 mol
B. 0,01 mol
C. 0,1 mol
D. 0,05 mol
Đáp án: C
n = 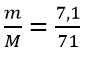 = 0,1 (mol)
= 0,1 (mol)
Câu 3: Tính %mMg trong 1 mol MgSO4
A. 80%
B. 30%
C. 50%
D. 20%
Đáp án: D
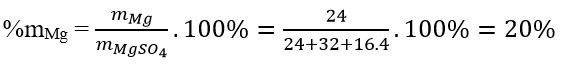
Câu 4: Số mol tương ứng của 4,8 g C; 8 g O; 0,56 g Fe
A. 0,04 mol, 0,5 mol, 0,1 mol
B. 0,4 mol, 0,5 mol, 0,01 mol
C. 4 mol, 5 mol, 1 mol
D. 0,4 mol, 0,1 mol, 0,3 mol
Đáp án: B
Sử dụng công thức n = m/M
Câu 5: Kết luận đúng khi nói về khí clo và khí metan
A. MCl2= MCH4
B. Khí clo nặng hơn 4,4375 lần khí metan
C. Khí metan nặng hơn khí clo 2,5 lần
D. Khí metan nặng hơn khí clo 4,4375 lần
Đáp án: B
dCl2/CH4 = 71/16 = 4,4375 ⇒ khí clo nặng hơn khí metan 4,4375 lần
Câu 6: Cho 1,6 g S cháy trong không khí thấy có khí có khả năng làm mất màu cánh hoa hồng. Tính thể tích khí đó
A. 1,12 ml
B. 0,102 l
C. 11,2 ml
D. 1,12 l
Đáp án: D
Khí làm mất màu cánh hoa hồng là khí SO2
S + O2 → SO2
0,05 0,05 mol
nS = 1,6/32 = 0,05 mol
VSO2 = 0,05.22,4 = 1,12 l
Câu 7: Cho 2,7 g nhôm tác dụng với 6,4 g O2 . Hỏi sau phản ứng thu được những chất nào, biết rằng hóa trị cao nhất của nhôm trong hợp chất là III
A. Al2O3
B. Al
C. O2
D. Al2O3 và O2 dư
Đáp án: D
Câu 8: Muốn thu khí NO vào bình ta phải
A. Đặt đứng bình
B. Đặt úp bình
C. Cách nào cũng được
D. Lúc đầu để đứng bình rồi chuyển sang để ngang bình
Đáp án: A
Câu 8: Xét tỉ khối của NO (M=34) so với không khí(M=29) ta thấy NO nặng hơn không khí nên sẽ chìm xuống dưới. Do vậy, để thu được NO ta phải đặt đứng bình
Câu 9: Tính khối lượng đã phản ứng của HCl khi cho 2,875 g Na tác dụng với nó để sinh ra khí hidro
A. 9,2 g
B. 4,5625 g
C. 12,95 g
D. 1,123 g
Đáp án: B
Câu 10: Cho dX/H2 = 0,12 nghĩa là gì
A. X nhẹ hơn H2 0,12 lần
B. X nặng hơn H2 0,12 lần
C. Số mol của X và hidro bằng nhau
D. Không kết luận được
Đáp án: A
*****************
Trên đây là nội dung bài học Hóa học 8 Bài 23: Bài luyện tập 4 do Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Bài luyện tập 4. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá
Chuyên mục: Hoá học 8
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/hoa-hoc-8-bai-23-bai-luyen-tap-4/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





