Hóa học 9 Hóa học 9 Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ được Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 9 Bài 13
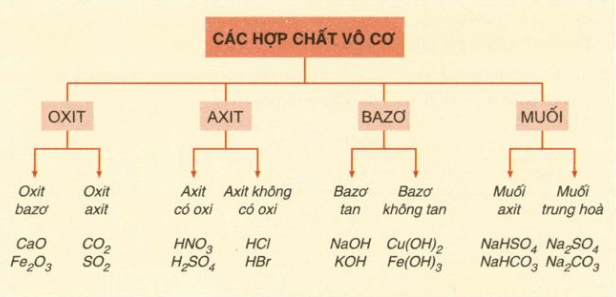
Bảng 1: Hệ thống, phân loại các hợp chất vô cơ:
Bạn đang xem bài: Hóa học 9 Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ – Giải bài tập SGK Hóa học 9 Bài 13
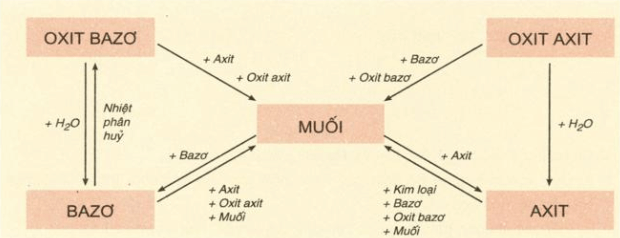
Bảng 2: Tính chất hóa học cơ bản của các hợp chất vô cơ
Giải bài tập SGK Hóa học 9 Bài 13
Bài 1 (trang 43 SGK Hóa 9)
Căn cứ vào sơ đồ biểu thị những tính chất hóa học của các hợp chất vô cơ:
1. Oxit
a) Oxit bazơ + … → bazơ
b) Oxit bazơ + … → muối + nước
c) Oxit axit + … → axit
d) Oxit axit + … → muối + nước
2. Bazơ
a) Bazơ + … → muối + nước
b) Bazơ + … → muối + nước
c) Bazơ + … → muối + bazơ
d) Bazơ oxit bazơ + nước
e) Oxit axit + oxit bazơ → …
3. Axit
a) Axit + … → muối + hiđro
b) Axit + … → muối + nước
c) Axit + … → muối + nước
d) Axit + … → muối + axit
4. Muối
a) Muối + … → axit + muối
b) Muối + … → muối + bazơ
c) Muối + … → muối + muối
d) Muối + … → muối + kim loại
e) Muối … + …
Lời giải:
1. Oxit
a) CaO + H2O → Ca(OH)2
b) MgO + 2HCl → MgCl2 + H2O
c) SO3 + H2O → H2SO4
d) CO2 + 2NaOH → Na2CO3 + H2O
e) CaO + CO2 → CaCO3
2. Bazơ
a) 2NaOH + H2SO4 → Na2SO4 + 2H2O
b) Ca(OH)2 + CO2 → CaCO3 + H2O
c) 2NaOH + CuCl2 → Cu(OH)2 ↓ + 2NaCl
d) 2Fe(OH)3 → Fe2O3 + 3H2O
3. Axit
a) 2HCl + Zn → ZnCl2 + H2 ↑
b) H2SO4 + Ca(OH)2 → CaSO4 (ít tan) + 2H2O
c) 2HNO3 + CaO → Ca(NO3)2 + H2O
d) H2SO4 + BaCl2 → BaSO4 ↓ + 2HCl
4. Muối
a) Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
b) FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
c) AgNO3 + NaCl → AgCl ↓ + NaNO3
d) Fe + CuSO4 → FeSO4 + Cu
e) 2KClO3 → 2KCl + 3O2 ↑ .
Bài 2 (trang 43 SGK Hóa 9)
Để một mẩu natri hiđroxit trên tấm kính trong không khí, sau vài ngày thấy có chất rắn màu trắng phủ ngoài. Nếu nhỏ vài giọt dung dịch HCl vào chất rắn thấy có khí thoát ra, khí này làm đục nước vôi trong. Chất rắn màu trắng là sản phẩm phản ứng của natri hiđroxit với:
a) Oxit trong không khí.
b) Hơi nước trong không khí.
c) Cacbon đioxit và oxi trong không khí.
d) Cacbon đioxit và hơi nước trong không khí.
e) Cacbon đioxit trong không khí.
Giải thích và viết phương trình hóa học minh họa.
Lời giải:
Câu e đúng.
2NaOH + CO2 → Na2CO3 + H2O
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
NaOH có tác dụng với HCl nhưng không giải phóng khí. Để khí bay ra làm đục nước vôi thì NaOH tác dụng với CO2 trong không khí cho Na2CO3 nên khi cho chất này tác dụng với HCl mới cho khí (CO2) làm đục nước vôi trong.
Bài 3 (trang 43 SGK Hóa 9)
Trộn một dung dịch có hòa tan 0,2 mol CuCl2 với một dung dịch có hòa tan 20g NaOH. Lọc hỗn hợp các chất sau phản ứng, được kết tủa và nước lọc. Nung kết tủa đến khi khối lượng không đổi.
a) Viết các phương trình hóa học.
b) Tính khối lượng chất rắn thu được sau khi nung.
c) Tính khối lượng các chất có trong nước lọc.
Lời giải:
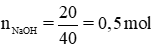
a) Phương trình hóa học của phản ứng:
2NaOH + CuCl2 → Cu(OH)2 ↓ + 2NaCl (1)
Cu(OH)2 to→ CuO + H2O (2)
b) Khối lượng chất rắn thu được sau khi nung:
Theo phương trình (1):
nNaOH = 2nCuCl2 = 0,4 mol
nNaOH dư = 0,5 – 0,4 = 0,1 mol
Tính khối lượng chất rắn CuO, theo (1) và (2) ta có:
nCuO = nCu(OH)2 = nCuCl2 = 0,2 mol
mCuO = 0,2 x 80 = 16g.
c) Khối lượng các chất trong nước lọc:
Khối lượng NaOH dư: mNaOH = 0,1 x 40 = 4g
Khối lượng NaCl trong nước lọc:
nNaCl = nNaOH = 0,4 mol
mNaCl = 0,4 x 58,5 = 23,4g.
Trắc nghiệm Hóa học 9 Bài 13 (có đáp án)
Câu 1: Có 3 lọ mất nhãn đựng riêng biệt 3 dung dịch của 3 chất: HCl, Na2SO4, NaOH . Chỉ dùng một hóa chất nào sau đây để phân biệt chúng ?
A. Dung dịch BaCl2
B. Quỳ tím
C. Dung dịch Ba(OH)2
D. Zn
Đáp án: B
Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl
+ Quỳ tím chuyển sang màu xanh → NaOH
+ Quỳ tím không chuyển màu → Na2SO4.
Câu 2: Khi cho từ từ dung dịch NaOH cho đến dư vào ống nghiệm đựng dung dịch hỗn hợp gồm HCl và một ít phenolphtalein. Hiện tượng quan sát được trong ống nghiệm là:
A. Màu đỏ mất dần.
B. Không có sự thay đổi màu
C. Màu đỏ từ từ xuất hiện.
D. Màu xanh từ từ xuất hiện.
Đáp án: C
Trong dung dịch sau phản ứng có NaOH dư làm cho phenolphtalein chuyển sang màu đỏ.
Câu 3: Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 13,6 g
B. 1,36 g
C. 20,4 g
D. 27,2 g
Đáp án: A
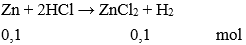
→ mmuối = 0,1.(65 + 35,5.2) = 13,6 gam.
Câu 4: Cho 0,2 mol Canxi oxit tác dụng với 500ml dung dịch HCl 1M. Khối lượng muối thu được là:
A. 2,22 g
B. 22,2 g
C. 23,2 g
D. 22,3 g
Đáp án: B
nHCl = 0,5.1 = 0,5 mol
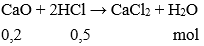
Có 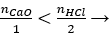 có HCl dư; số mol muối = số mol CaO = 0,2 mol
có HCl dư; số mol muối = số mol CaO = 0,2 mol
mmuối = 0,2. (40 + 71) = 22,2 gam.
Câu 5: Dung dịch axit clohiđric tác dụng với sắt tạo thành:
A. Sắt (II) clorua và khí hiđrô.
B. Sắt (III) clorua và khí hiđrô.
C. Sắt (II) Sunfua và khí hiđrô.
D. Sắt (II) clorua và nước.
Đáp án: A
Fe + 2HCl → FeCl2 + H2
Câu 6: Dung dịch muối tác dụng với dung dịch axit clohiđric là:
A. Zn(NO3)2
B. NaNO3.
C. AgNO3.
D. Cu(NO3)2.
Đáp án: C
AgNO3 + HCl → AgCl ↓ + HNO3
Câu 7: Axit sunfuric đặc nóng tác dụng với đồng kim loại sinh ra khí:
A. CO2.
B. SO2.
C. SO3.
D. H2S.
Đáp án: B
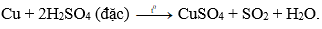
Câu 8: Dãy các kim loại đều tác dụng với dung dịch axit clohiđric:
A. Al, Cu, Zn, Fe.
B. Al, Fe, Mg, Ag.
C. Al, Fe, Mg, Cu.
D. Al, Fe, Mg, Zn.
Đáp án: D
Cu và Ag không tác dụng với axit HCl.
Câu 9: Thuốc thử để nhận biết dung dịch Ca(OH)2 là
A. K2CO3
B. KCl
C. KOH
D. KNO3
Đáp án: A.
Ca(OH)2 + K2CO3 → CaCO3 ↓ + 2KOH
Câu 10: Hòa tan 3,1 gam Na2O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là:
A. 0,05 M
B. 0,1 M
C. 0,3M
D. 0,4M
Đáp án: A
Số mol Na2O = 3,1 : 62 = 0,05 mol
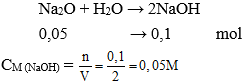
******************
Trên đây là nội dung bài học Hóa học 9 Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ do Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Luyện tập chương 1: Các loại hợp chất vô cơ. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá
Chuyên mục: Hoá học 9
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/hoa-hoc-9-bai-13-luyen-tap-chuong-1-cac-loai-hop-chat-vo-co/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục