Bài 1 trang 186 SGK Hóa 11
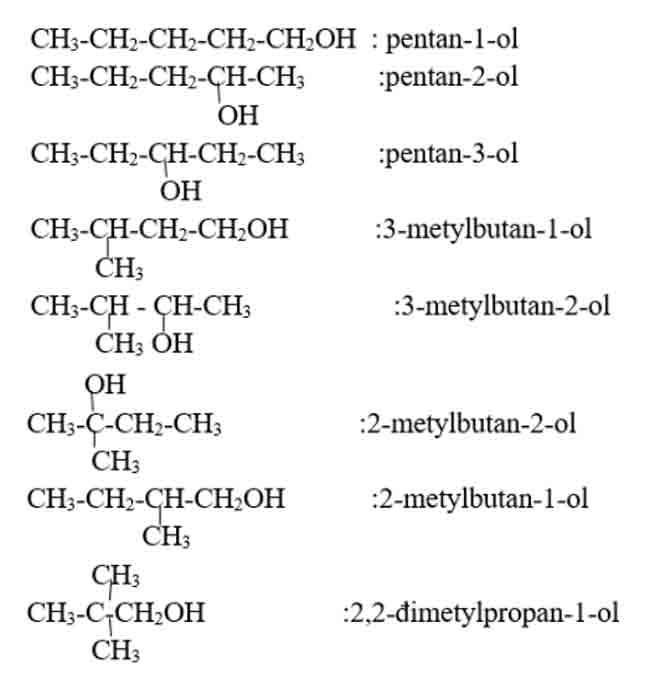
Bài 1 (trang 186 SGK Hóa 11): Viết công thức cấu tạo và gọi tên các ancol đồng phân có công thức phân tử C5H12O?
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
– Công thức cấu tạo và gọi tên:
Bài 2 trang 186 SGK Hóa 11
Bài 2 (trang 186 SGK Hóa 11): Viết phương trình hóa học của phản ứng propan-1-ol với mỗi chất sau:
a. Natri kim loại.
b. CuO, đun nóng
c. Axit HBr, có xúc tác
Trong mỗi phản ứng trên ancol giữ vai trò gì: chất khử, chất oxi hoá, axit, bazơ? Giải thích.
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
a) 2CH3-CH2-CH2OH + 2Na → 2CH3-CH2-CH2ONa + H2↑
Ancol đóng vai trò chất oxi hóa
b) CH3-CH2-CH2OH + CuO → CH3-CH2-CHO + Cu + H2O
Ancol đóng vai trò chất khử
c) CH3-CH2-CH2OH + HBr → CH3-CH2-CH2Br + H2O
Ancol đóng vai trò bazơ
Bài 3 trang 186 SGK Hóa 11
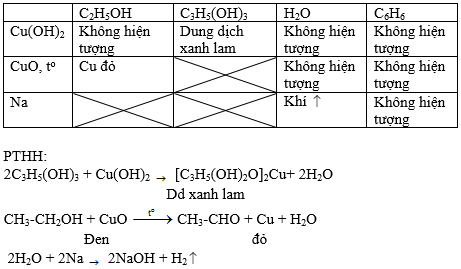
Bài 3 (trang 186 SGK Hóa 11): Trình bày phương pháp hoá học để phân biệt các chất lỏng đựng trong các lọ không dán nhãn: etanol, glixerol, nước và benzen.
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
Bài 4 trang 186 SGK Hóa 11
Bài 4 (trang 186 SGK Hóa 11): Từ propen và các chất vô cơ cần thiết có thể điều chế được các chất nào sau đây: propan-2-ol (1); propan-1,2-điol (2). Viết các phương trình hoá học của phản ứng xảy ra.
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
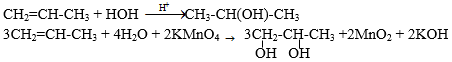
Bài 5 trang 187 SGK Hóa 11
Bài 5 (trang 187 SGK Hóa 11): Cho 12,20 gam hỗ hợp X gồm etanol và propan-1-ol tác dụng với Na (dư) thu được 2,80 lit khí đktc.
a. Tính thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp X?
b. Cho hỗn hợp X qua ống đựng CuO, đun nóng. Viết các phương trình hoá học của phản ứng xảy ra.
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
a) Gọi số mol của etanol và propan-1-ol lần lượt là x và y (mol)
Phương trình phản ứng:

b) Phương trình phản ứng:
CH3-CH2OH + CuO −to→ CH3-CHO + Cu + H2O
CH3-CH2-CH2OH + CuO −to→ CH3-CH2-CHO + Cu + H2O
Bài 6 trang 187 SGK Hóa 11
Bài 6 (trang 187 SGK Hóa 11): Oxi hoá hoàn toàn 0,60(g) một ancol A đơn chức bằng oxi không khí, sau đó dẫn sản phẩm qua bình (1) đựng H2SO4 đặc rồi dẫn tiếp qua bình (2) đựng KOH. Khối lượng bình (1) tăng 0,72g; bình (2) tăng 1,32g.
a. Giải thích hiện tượng thí nghiệm trên bằng phương trình hoá học.
b. Tìm công thức phân tử, viết công thức cấu tạo có thể có của A.
c. Khi cho ancol trên tác dụng với CuO, đun nóng thu được một anđehit tương ứng. Gọi tên của A?
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
a.
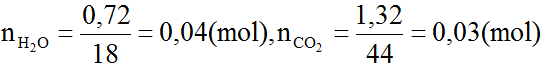
⇒ nH2O > nCO2
⇒ A là ancol no và theo đầu bài là đơn chức
Gọi công thức phân tử của A là CnH2n+2O (n ≥ 1)
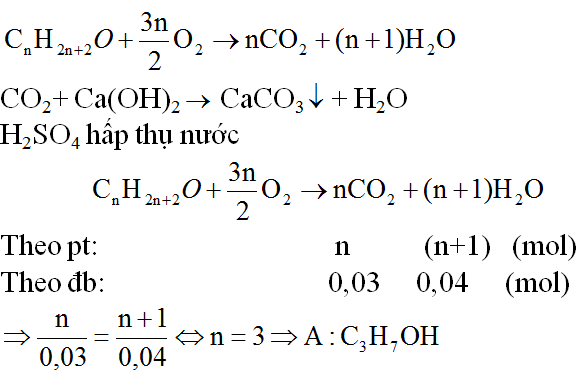
b. CTCT có thể có của A là:
CH3-CH2-CH2-OH, CH3-CH(OH)-CH3
c. Khi cho A tác dụng với CuO, đun nóng được một anđehit ⇒ A là Ancol bậc 1
⇒ CTCT của A là: CH3-CH2-CH2-OH (propan-1-ol)
Bài 7 trang 187 SGK Hóa 11
Bài 7 (trang 187 SGK Hóa 11): Từ 1,00 tấn tinh bột chứa 5,0% chất xơ (Không bị biến đổi) có thể sản xuất đưuọc bao nhiêu lit etanol tinh khiết, biết hiệu suất chung của cả quá trình là 80,0% và khối lượng riêng của etanol là D = 0,789 g/ml.
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
(C6H10O5)n + nH2O → nC6H12O6 (1)
C6H12O6 → 2C2H5OH + 2CO2 (2)
mxơ = 0,05. 106 (g)
⇒ Khối lượng tinh bột = 1.106 – 0,05.106 = 0,95.106 (g)
Từ (1) và (2) ta có:
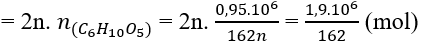
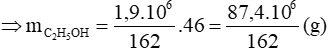
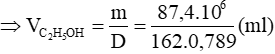
Mà hiệu suất chung của cả quá trình sản xuất là 80% nân thể tích etanol thực tế thu được là:
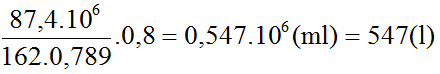
Bài 8 trang 187 SGK Hóa 11
Bài 8 (trang 187 SGK Hóa 11): Cho ancol
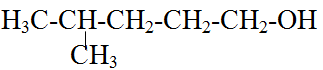
Tên gọi nào dưới đấy ứng với ancol trên?
A. 2-metylpentan-1-ol ; B. 4-metylpentan-1-ol
C. 4-metylpentan-2-ol ; D. 3-metylpentan-2-ol
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
Đáp án B
Bài 9 trang 187 SGK Hóa 11
Bài 9 (trang 187 SGK Hóa 11): Cho 3,70gam một ancol X no, đơn chức, mạch hở tác dụng với Na dư có thấy 0,56 lit khí thoát ra (ở đktc). Công thức phân tử của X là:
A. C2H6O ; B. C3H10O
C. C4H10O ; D. C4H8O
Hãy chọn đáp án đúng
Lời giải:
Bạn đang xem bài: Hóa học lớp 11 Bài 40 – Ancol
– Đáp án C
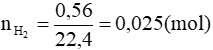
2R-OH + 2Na → 2R-ONa + H2↑
0,05 ← 0,025 (mol)
Theo pt nR-OH = 2. nH2 = 2. 0,025 = 0,05 mol
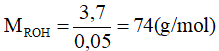
Ancol no đơn chức có công thức CnH2n + 1OH → 14n + 18 = 74 → n = 4
Vậy công thức phân tử của X là: C4H10O
Tính chất của Ancol: tính chất hóa học, tính chất vật lí, danh pháp, điều chế, ứng dụng
I. Định nghĩa, phân loại, đồng phân và danh pháp
1. Định nghĩa
Ancol là những hợp chất hữu cơ mà phân tử có nhóm hidroxyl (OH) liên kết trực tiếp với nguyên tử cacbon no.
Công thức tổng quát của ancol: R(OH)n (n ≥ 1), với R là gốc hiđrocacbon.
– Công thức của ancol no mạch thẳng, đơn chức: CnH2n+1OH hay CnH2n+2O (với n ≥ 1).
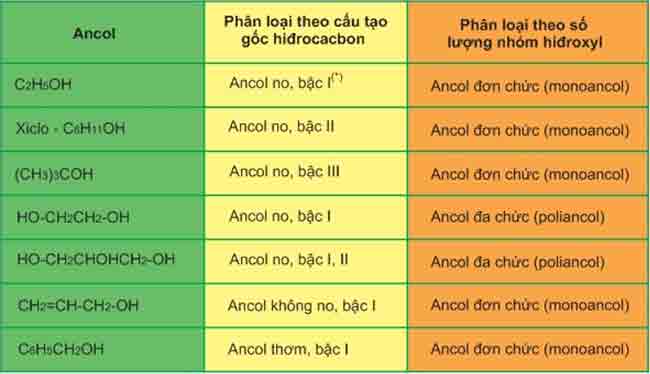
2. Phân loại
– Gốc R có thể là mạch hở no hay chưa no hoặc mạch vòng.
Ví dụ: CH3-OH; CH2=CH-CH2-OH; C6H5-CH2-OH.
– Nhóm OH- có thể dính vào cacbon bậc 1, bậc 2, bậc 3 tạo thành ancol tương ứng bậc 1, bậc 2, bậc 3.
Lưu ý: Bậc của ancol bằng bậc của nguyên tử cacbon liên kết với nhóm OH.
Ví dụ:
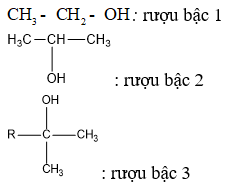
Bảng phân loại ancol
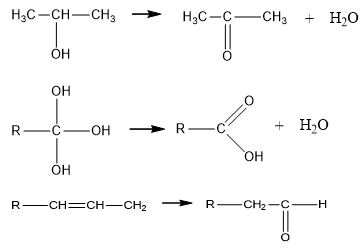
– Ancol không bền khi:
+ Nhiều nhóm –OH cùng đính vào một nguyên tử cacbon.
+ Nhóm –OH đính vào nguyên tử cacbon có nối đôi.
Ví dụ:
3. Đồng phân và danh pháp
a. Đồng phân
– Mạch cacbon khác nhau.
– Vị trí của các nhóm –OH khác nhau.
– Ngoài ra ancol đơn chức có đồng phân là ete: R-O-R’.
Ví dụ: Viết đồng phân của C3H8O.
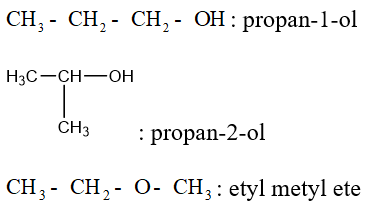
b. Danh pháp
– Tên thông thường: Tên ancol = tên gốc hiđrocacbon no tương ứng + ic.
Ví dụ:
CH3-CH2-OH: ancol etylic.
CH3-OH: ancol metylic.
– Tên thay thế: Tên ancol = tên gốc hiđrocacbon no tương ứng + ol.
Ví dụ:
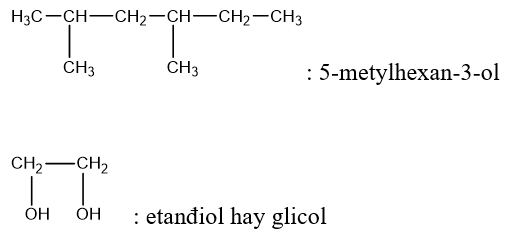
II. Tính chất vật lý
– Các ancol có nhiệt độ sôi cao hơn các hiđcacbon có cùng phân tử khối hoặc đồng phân ete của nó là do giữa các phân tử ancol có liên kết hiđro → Ảnh hưởng đến độ tan.
– Từ C1 đến C12 ancol ở thể lỏng (khối lượng riêng d 13 trở lên ở thể rắn.
– C1 đến C3 tan vô hạn trong nước vì có liên kiết H với nước.
– Độ rượu = (Vancol nguyên chất/Vdd ancol).100
– Các poli như etylen glicol, glixerol thường sánh, nặng hơn nước và có vị ngọt.
III. Tính chất hóa học
1. Phản ứng thế nguyên tử hiđro của nhóm OH ancol (phản ứng đặc trưng của Ancol)
– Tính chất chung của ancol:
2ROH + Na → 2RONa + H2↑
– Tính chất đặc trưng của glixerol:
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + H2O
(ĐK: muốn tác dụng với Cu(OH)2 phải có 2 nhóm -OH trở lên liền kề nhau)
→ Phản ứng này dùng để phân biệt ancol đơn chức với ancol đa chức có 2 nhóm OH cạnh nhau trong phân tử.
2. Phản ứng thế nhóm OH
– Phản ứng với axit vô cơ:
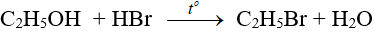
– Phản ứng tạo dien: dùng sản xuất cao su buna.
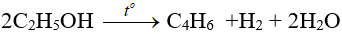
(ĐK: phải có xúc tác là Al2O3 + MgO hoặc ZnO/500ºC)
3. Phản ứng tách nước (phản ứng đêhidrat hoá)
Chú ý:
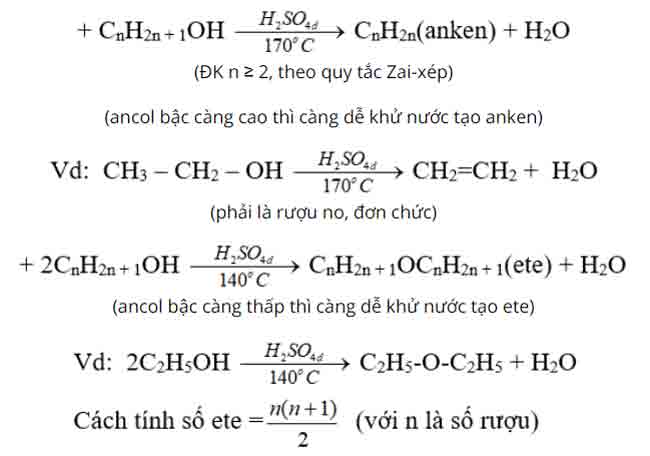
4. Phản ứng oxi hoá
– Phản ứng oxi hoá hoàn toàn:
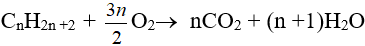
– Phản ứng oxi hoá không hoàn toàn:
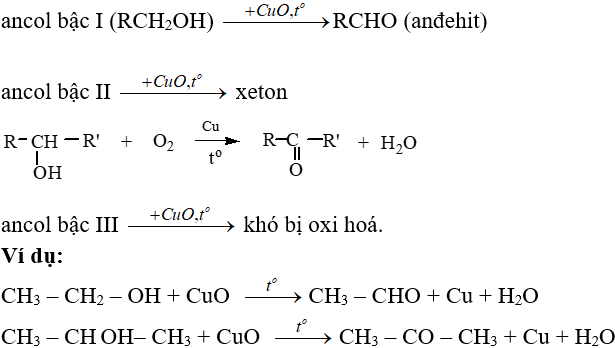
IV. Ứng dụng và điều chế
1. Ứng dụng
2. Điều chế
a. Phương pháp tổng hợp
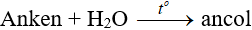
Ví dụ: Điều chế etanol từ etilen CH2=CH2 + H2O → CH3CH2OH
b. Phương pháp sinh hoá: từ tinh bột, đường, …
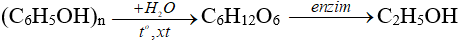
c. Điều chế metanol trong công nghiệp
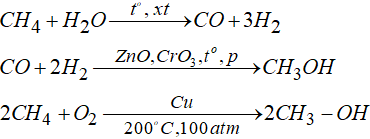
* Giới thiệu một số rượu
a. Rượu metylic (CH3OH)
– Là chất lỏng, không màu, nhẹ hơn nước, tan vô hạn trong nước, có mùi đặc trưng, nhiệt độ sôi 65oC.
– Rất độc: nếu uống phải dễ mù mắt, uống nhiều có thể gây tử vong.
– Dùng để điều chế anđehit fomic, tổng hợp chất dẻo, làm dung môi.
– Điều chế:
+ Tổng hợp trực tiếp:
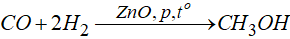
+ Bằng cách trưng gỗ.
b. Rượu etylic (C2H5OH)
– Là chất lỏng, nhẹ hơn nước, tan vô hạn trong nước, có mùi thơm, nhiệt độ sôi 78oC.
– Có ứng dụng rất lớn trong thực tế: để chế tạo cao su và một số chất tổng hợp khác như este, axit axetic, ete, … Để làm dung môi hòa tan vecni, dược phẩm, nước hoa.
c. Rượu butylic (C4H9OH)
– Có 4 đồng phân. Là những chất lỏng, ít tan trong nước hơn 3 chất đầu dãy đồng đẳng. Có mùi đặc trưng.
d. Rượu allylic (CH2=CH-CH2OH)
– Là chất lỏng không màu, mùi xốc, nhiệt độ sôi 97oC.
– Được dùng để sản xuất chất dẻo.
– Khi oxi hóa ở vị trí nối đôi tạo thành glixerol.
e. Một số rượu đa chức
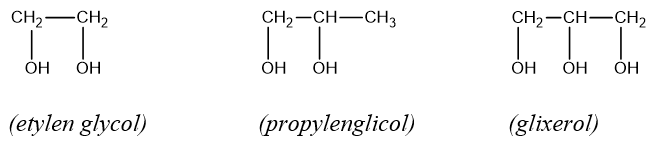
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/hoa-hoc-lop-11-bai-40-ancol/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục