Phương trình hóa học hay còn gọi là phương trình phản ứng trong hóa học là nội dung kiến thức nền tảng giúp các em có thể phân loại và dễ nhớ tính chất hóa học của các nguyên tố và hợp chất.
Trong bài viết này chúng ta cùng phân loại các phản ứng trong hóa học vô cơ, qua đó giúp các em có thể hiểu sâu hơn về các dạng của phương trình phản ứng trong tính chất hóa học của các nguyên tố và hợp chất của nó.
Bạn đang xem bài: Phân loại phản ứng trong hóa học vô cơ, ví dụ và bài tập – hóa 10 bài 18
I. Phản ứng có sự thay đổi số oxi hóa và phản ứng không có sự thay đổi số oxi hóa
1. Phản ứng hoá hợp
– Là phản ứng hóa học, trong đó 2 hay nhiều chất hóa hợp với nhau tạo thành một chất mới.
CaO + CO2 → CaCO3
4P + O2 → P2O5
– Tгопg phản ứng hoá hợp. số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
2. Phản ứng phân huỷ
– Là phản ứng hóa học, trong đó một chất bị phân hủy thành 2 hay nhiều chất mới
2KClO3 → 2KCl + 3O2↑
2Fe(OH)3 → Fe2O3 + 3H2O
– Trong phản ứng phân huỷ. số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
3. Phản ứng thế
– Là phản ứng hóa học, trong đó nguyên tử của nguyên tố này ở dạng đơn chất thay thế nguyên tử của nguyên tố khác trong hợp chất.
Fe + HCl → FeCl2 + H2↑
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
– Trong hoá học vô cơ, phản ứng thế bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố.
4. Phản ứng trao đổi
– Là phản ứng hóa học, trong đó các hợp chất trao đổi nguyên tử hay nhóm nguyên tử với nhau
AgNO3 + NaCl → AgCl↓ + NaNO3
2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
– Trong phản ứng trao đổi, số oxi hoá của các nguyên tố không thay đổi.
* Kết luận:
– Dựa vào sự thay đổi số oxi hoá, có thể chia phản ứng hoá học thành hai loại:
a) Phản ứng hoá học có sự thay đổi số oxi hoá là phản ứng oxi hoá – khử.
– Các phản ứng thế, một số phản ứng hoá hợp và một sô phản ứng phân huỷ thuộc loại phản ứng hoá học này.
b) Phản ứng hoá học không có sự thay dổi số oxi hoá, không phải là phản ứng oxi hoá – khử.
– Các phản ứng trao đổi, một số phản ứng hoá hợp và một số phản ứng phân huỷ thuộc loại phản ứng hoá học này.
II. Phản ứng thu nhiệt và phản ứng tỏa nhiệt
– Phản ứng tỏa nhiệt: là phản ứng hóa học giải phóng năng lượng dưới dạng nhiệt.
* Thí dụ: Phản ứng đốt cháy xăng dầu, cung cấp năng lượng để vận hành xe cộ, máy móc,…
– Phản ứng thu nhiệt: là phản ứng hóa học hấp thụ năng lượng dưới dạng nhiệt.
* Thí dụ: Khi sản xuất vôi, người ta phải liên tục cung cấp năng lượng dưới dạng nhiệt để thực hiện phản ứng phân hủy đá vôi.
III. Bài tập phân loại phản ứng hoá học
Bài 1 trang 86 SGK Hóa 10: Cho phản ứng : 2Na + Cl2 → 2NaCl. Trong phản ứng này, nguyên tử natri.
A. bị oxi hóa.
B. bị khử.
C. vừa bị oxi hóa, vừa bị khử.
D. không bị oxi hóa, không bị khử.
Chọn đáp án đúng
* Lời giải bài 1 trang 86 SGK Hóa 10:
– Đáp án: A đúng. Natri bị oxi hoá (Natri nhường electron).
Bài 2 trang 86 SGK Hóa 10: Cho phản ứng: Zn + CuCl2 → ZnCl2 + Cu.
Trong phản ứng này, 1 mol ion Cu2+;
A. đã nhận 1 mol electron.
B. đã nhận 2 mol electron.
C. đã nhường 1 mol electron.
D. đã nhường 2 mol electron.
Chọn đáp án đúng.
* Lời giải bài 2 trang 86 SGK Hóa 10:
– Đáp án: B đúng. Cu2+ đã nhận 2 mol electron.
Cu2+ + 2e → Cu
⇒ 1 mol Cu2+ đã nhận 2mol electron
Bài 3 trang 86 SGK Hóa 10: Cho các phản ứng sau:
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng nào không phải phản ứng oxi hóa – khử?
* Lời giải bài 3 trang 86 SGK Hóa 10:
– Đáp án: A đúng: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
– Vì không có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng
Bài 4 trang 86 SGK Hóa 10: Dấu hiện để nhận biết một phản ứng oxi hóa – khử:
A. Tạo ra chất kết tủa.
B. Tạo ra chất khí.
C. Có sự thay đổi màu sắc của các chất.
D. Có sự thay đổi số oxi hóa của một hay một số nguyên tố.
Chọn đáp án đúng.
* Lời giải bài 4 trang 86 SGK Hóa 10:
– Đáp án: D đúng. Có sự thay đổi số oxi hóa của một hay một số nguyên tố.
Bài 5 trang 87 SGK Hóa 10: Trong những phản ứng sau đây, phản ứng nào là phản ứng oxi hóa – khử? Giải thích.
a) SO3 + H2O → H2SO4
b) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
c) C + H2O → CO + H2
d) CO2 + Ca(OH)2 → CaCO3 + H2O
e) Ca + 2H2O → Ca(OH)2 + H2
f) 2KMnO4 → K2MnO4 + MnO2 + O2
* Lời giải bài 5 trang 87 SGK Hóa 10:
– Trong những phản ứng trên chỉ có phản ứng c), e), f) là những phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của các nguyên tố
c) C + H2O → CO + H2
Số oxi hoá của C tăng từ 0 lến +2, H giảm từ +1 về 0
e) Ca + 2H2O → Ca(OH)2 + H2
Số oxi hoá của Ca tăng từ 0 lến +2, H giảm từ +1 về 0
f) 2KMnO4 → K2MnO4 + MnO2 + O2
Số oxi hoá của O tăng từ -2 lên 0, Mn giảm từ +7 về +6 và +4.
Bài 6 trang 87 SGK Hóa 10: Lấy ba thí dụ phản ứng hóa hợp thuộc loại phản ứng oxi hóa – khử và ba thí dụ phản ứng hóa hợp không là loại phản ứng oxi hóa – khử.
* Lời giải bài 6 trang 87 SGK Hóa 10:
– Ba thí dụ phản ứng hóa hợp thuộc loại phản ứng oxi hóa – khử:
3Fe + 2O2 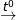 Fe3O4
Fe3O4
H2 + Cl2 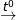 HCl
HCl
O2 + H2 → H2O
– Ba thí dụ phản ứng hóa hợp KHÔNG THUỘC loại phản ứng oxi hóa – khử :
CaO + CO2 → СаСОз
Na2O + H2O → 2NaOH
SO3 + H2O → H2SO4.
Bài 9 trang 87 SGK Hóa 10: Viết phương trình hóa học của các phản ứng biểu diễn các chuyển đổi sau:
a) 
b) 
Trong các phản ứng trên, phản ứng nào là phản ứng oxi hóa – khử?
* Lời giải bài 9 trang 87 SGK Hóa 10:
a) (1) 2KClO3 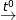 2KCl + O2↑
2KCl + O2↑
(2) S + O2 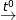 SO2
SO2
(3) SO2 + NaOH → Na2SO3 + H2O
⇒ Phản ứng oxi hóa – khử là (1) và (2).
b) (1) S + H2 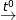 H2S
H2S
(2) 2H2S + 3O2 → 2SO2 + 2H2O
(3) 2SO2 + O2 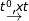 2SO3
2SO3
(4) SO3 + H2O → H2SO4
⇒ Phản ứng oxi hóa – khử là: (1), (2), (3)
Hy vọng với bài viết về phân loại phản ứng trong hoá học vô cơ và bài tập vận dụng ở trên hữu ích cho các em. Mọi thắc mắc và góp ý các em vui lòng để lại bình luận dưới bài viết để HayHocHoi.Vn nghi nhận và hỗ trợ, chúc các em học tập tốt.
tmdl.edu.vn. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn/phan-loai-phan-ung-trong-hoa-hoc-vo-co-vi-du-va-bai-tap-hoa-10-bai-18/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục




