Trong các loại hóa chất nổi bật, axit nitric là hợp chất hoá học phổ biến trong đời sống hiện nay. Vậy tính chất hóa học của HNO3 là gì. Mời các bạn tham khảo bài viết dưới đây với Tmdl.edu.vn nhé!
Axit nitric HNO3 là gì?
Axit nitric HNO3 là gì?
Axit nitric HNO3 là hợp chất vô cơ có công thức hóa học HNO3. Axit nitric HNO3 thường được xem làm một dung dịch nitrat hidro hay còn được gọi là axit nitric khan. Loại axit này được hình thành trong tự nhiên, do trong những cơn mưa do sấm và sét tạo thành.
Bạn đang xem bài: Tính chất hóa học của HNO3 là gì? 8 lưu ý khi sử dụng
Được tài trợ
Nếu một dung dịch có hơn 86% axit nitric, nó được gọi là axit nitric bốc khói. Axit nitric bốc khói có đặc trưng axit nitric bốc khói trắng và axit nitric bốc khói đỏ, tùy thuộc vào số lượng nitơ đioxit hiện diện.
Được tài trợ
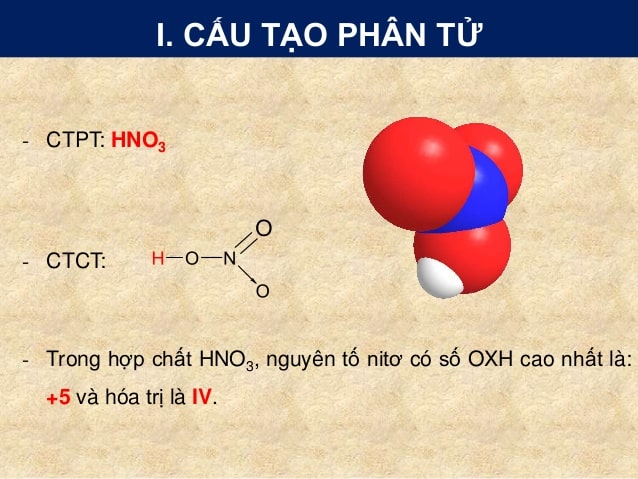
Cấu tạo của phân tử axit nitric HNO3
CTPT: HNO3
Trong hợp chất HNO3, nguyên tố N2 có số OXH cao nhất là : +5, và hóa trị IV.
Sau khi tìm hiểu những khái niệm và cấu trúc của HNO3. Thì cùng Tmdl.edu.vn vào nội dung tính chất hóa học của HNO3 ngay nhé!
Bài viết liên quan:
Tính chất hóa học của HNO3
HN03 được biết như một tính axit và oxy hóa cực mạnh. Trong nội dung cụ thể dưới đây, Tmdl.edu.vn sẽ đi chi tiết từng tính chất hóa học của HNO3 nhé!
HNO3 là một axit mạnh
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với oxit bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
- 2HNO3 + CuO → Cu(NO3)2 + H2O
- Tác dụng với bazơ (trong đó kim loại đã đạt hóa trị cao nhất) → muối + H2O:
- HNO3 + KOH → KNO3 + H2O
- Tác dụng với muối (trong muối kim loại đã đạt hóa trị cao nhất) → muối mới + axit mới:
- 2HNO3 + CaCO3 → Ca(NO3)2 + CO2↑ + H2O
Kết luận: HNO3 là một axit mạnh (do HNO3 phân ly thành H+ và NO3-).
HNO3 là chất oxi hóa mạnh
Axit nitric tác dụng với kim loại
- HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt → muối nitrat + H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
M + HNO3 → M(NO3)n + H2O + NO2 (NO, N2O, N2, NH4NO3)
- Theo áp dụng tính chất hóa học của HNO3, ta có PTHH sau:
- Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O
- 3Cu + 8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
- Sản phẩm khử của N+5 là tùy thuộc vào độ mạnh của kim loại và nồng độ của dung dịch axit, thông thường thì:
- Dung dịch HNO3 đặc tác dụng với kim loại → NO2;
- Dung dịch HNO3 loãng tác dụng với kim loại khử yếu (như: Cu, Pb, Ag,…) → NO;
- Dung dịch HNO3 loãng tác dụng với kim loại mạnh (như: Al, Mg, Zn,…) thì N bị khử xuống mức càng sâu → (N2, N2O, NH4NO3).
Lưu ý: Nếu cho Fe hoặc hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 mà sau phản ứng còn dư kim loại → trong dung dịch Fe thu được chỉ ở dạng muối Fe2+. HNO3 đặc nguội thụ động với Al, Fe, Cr.
Tác dụng với phi kim → NO2 + H2O + oxit của phi kim
Khi đun nóng HNO3 đặc có thể tác dụng với phi: C, P, S,…(trừ N2 và halogen). Theo áp dụng tính chất hóa học của HNO3, ta có PTHH sau:
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
Tác dụng với các chất khử khác (oxit bazơ, bazơ và muối trong đó kim loại chưa có hóa trị cao nhất,…).
H2S, HI, SO2, FeO, muối sắt (II),… có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn.
Theo áp dụng tính chất hóa học của HNO3, ta có PTHH sau:
- 3FeO + 10HNO3(đ) → 3Fe(NO3)3 + NO + 5H2O
- 3H2S + 2HNO3(đ) → 3S + 2NO + 4H2O
Nhiều hợp chất hữu cơ như giấy, vải, dầu thông,… bốc cháy khi tiếp xúc với HNO3 đặc.

Tính chất vật lý của HNO3
Ngoài những tính chất hóa học của HNO3 đặc trưng trên. Dưới đây là các tính chất vật lý của HNO3 mà bạn nên ghi lại để học và phân tích:
- HNO3 là chất lỏng không màu, D = 1,53g/cm3, sôi ở 860 độ C.
- Trong phòng thí nghiệm thường có loại axit đặc nồng độ 68%, D=1,40g/cm3.
- Axit nitric HNO3 bốc khói mạnh trong không khí ẩm.
- Axit nitric tan trong nước theo bất kì tỉ lệ nào.
- Trong điều kiện thường, dung dịch có màu hơi vàng do HNO3 bị phân hủy chậm:
4HNO3 → 4NO2 + 2H2O + O2 → phải đựng dung dịch HNO3 trong bình tối màu.
- Axit nitric không bền, khi có ánh sáng phân hủy một phần. Theo áp dụng tính chất hóa học của HNO3, ta có PTHH sau:
4HNO3 → 4NO2 + O2 + 2H2O
Cách điều chế axit nitric HNO3
Áp dụng tính chất hóa học của HNO3, ta có 2 cách điều chế HNO3 sau đây:
Điều chế axit nitric HNO3 trong phòng thí nghiệm
Vì điều chế trong phòng thí nghiệm không cần số lượng lớn. Nên ta có thể sử dụng các loại muối nitrat và H2SO4 để tạo thành HNO3.
Theo áp dụng tính chất hóa học của HNO3, ta có PTHH sau:
- H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
Điều chế axit nitric HNO3 trong công nghiệp
Axit nitric loãng có thể cô đặc đến 68% axit với một hỗn hợp azeotropic với 32% nước. Để thu được axit có nồng độ cao hơn, tiến hành chưng cất với axit sunfuric H2SO4. H2SO4 đóng vai trò là chất khử sẽ hấp thụ lại nước.
Theo áp dụng tính chất hóa học của HNO3, ta có PTHH sau:
- 4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
- 2NO + O2 → NO2
- 4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit nitric công nghiệp thường có nồng độ 52% và 68%. Việc sản xuất axit nitric được thực hiện bằng công nghệ Ostwald do Wilhelm Ostwald phát minh.
Axit nitric HNO3 có nguy hiểm không?
Axit nitric HNO3 rất nguy hiểm. Axit có nhiều loại, trong đó có 3 loại axit vô cơ mạnh thường gây bỏng đó là axit sunfuric (H2SO4), axit nitric (HNO3) và axit clohidric (HCl). Đây đều là các axit có tính oxy hóa mạnh, nhất là ở nồng độ đậm đặc sẽ gây bỏng và tổn thương nhanh chóng khi tiếp xúc trực tiếp qua da.
Tiếp xúc với axit nitric HNO3 sẽ như thế nào?
Tiếp xúc với axit nitric HNO3 sẽ có thể gây bỏng, hoại tử da, điếc, mù mắt. Thậm chí tính mạng của nạn nhân cũng bị đe dọa.
Do axit có thể phản ứng với các protein trên cơ thể bao gồm da, móng tay, chân, tóc,… Nên khi tiếp xúc, axit nhanh chóng làm vón đông các protein trên da và hút nước của tế bào, gây ra những tổn thương nặng nề.

Cách xử lý sự cố do axit nitric HNO3 gây ra
Theo tính chất hóa học của HNO3 thì ta có những biện pháp xử lý sự cố do axit nitric gây ra như sau:
- Khi bạn lỡ hít phải thì hãy tìm kiếm không khí trong lành và chăm sóc y tế ngay lập tức.
- Vô tình HNO3 tiếp xúc với mắt bạn. Bạn hãy ngay lập tức rửa mắt bằng nhiều nước trong ít nhất 15 phút để ngăn ngừa tổn thương thêm. Sau đó bạn lập tức tìm kiếm sự chăm sóc y tế.
- Nếu HNO3 tiếp xúc với da hãy ngay lập tức rửa sạch vùng bị ảnh hưởng với nhiều nước trong ít nhất 15 phút. Loại bỏ quần áo bị ô nhiễm và rửa bằng xà bông. Chăm sóc y tế ngay lập tức khi được yêu cầu.
- Nếu bạn nuốt phải súc miệng bằng nước hoặc sữa. Lưu ý rằng không được phép cho bất cứ thứ gì vào miệng của nạn nhân, khi họ đã bất tỉnh để tránh những trường hợp kích ứng. Tìm kiếm sự chăm sóc y tế nhanh nhất có thể.
Kế luận: Bạn nên trang bị đầy đủ những thiết bị bảo hộ an toàn như kính mắt, khẩu trang, mũ, găng tay, quần áo dài tay, giày,… Đặc biệt, thường xuyên giữ cho nơi làm việc được sạch sẽ, thông thoáng, để xa những đồ dễ cháy nổ.

Lưu ý khi sử dụng axit nitric HNO3
Khi nắm rõ tính chất hóa học của HNO3 thì hãy cẩn thận và lưu ý những điểm sau đây khi sử dụng HNO3:
- Axit nitric là chất oxy hóa mạnh, khi tác dụng với cyanit, bột kim có thể phát nổ và tự bốc cháy khi phản ứng với turpentine.
- Ở nồng độ đậm đặc, nó gây bỏng da do phản ứng với protein keratin, khiến da chuyển sang màu vàng. Khi được trung hòa sẽ chuyển thành màu cam.
- Theo tính chất hóa học của HNO3, nó có thể phản ứng mạnh với kim loại tạo thành khí hydro dễ cháy trong không khí.
- Khi pha loãng, tuyệt đối không được đổ nước vào axit mà phải cho axit vào nước.
- Sử dụng các thùng chứa bằng nhựa thay cho kim loại vì axit nitric không tác dụng với chất liệu này.
- Các thùng chứa phải đậy nắp kín, tránh ánh nắng mặt trời.
- Khu vực lưu trữ phải thoáng mát, tránh xa các nguồn nhiệt.
- Nền nhà phải chống được axit.
Trước khi tiếp xúc, bạn phải nắm vững các tính chất hóa học của HNO3. Sau đó, hãy thật chú ý chuẩn bị cẩn thận đế không xảy ra sự cố đáng tiếc nhé!

Hy vọng các bạn biết được HNO3 là gì và các tính chất hóa học của HNO3. Đừng quên share và follow bài viết để Tmdl.edu.vn có thêm động lực chia sẻ kiến thức nữa nhé.
Trang chủ: tmdl.edu.vn
Danh mục bài: Tổng hợp



