Zn + HNO3 → Zn(NO3)2 + N2 + H2O là phương trình oxi hóa khử được Tmdl.edu.vn biên soạn hướng dẫn các bạn học viết và cân bằng chính xác phản ứng khi cho Zn tác dụng với HNO3 loãng theo phương pháp thăng bằng electron. Mời các bạn tham khảo.
1. Phương trình phản ứng Zn tác dụng HNO3 loãng ra N2
5Zn + 12HNO3 → 5Zn(NO3)2 + N2 + 6H2O
2. Hướng dẫn cân bằng phản ứng Zn tác dụng HNO3 loãng
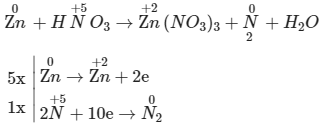
Bạn đang xem bài: Zn + HNO3 → Zn(NO3)2 + N2 + H2O
→ 5Zn + 12HNO3 → 5Zn(NO3)2 + N2 + 6H2O
3. Điều kiện phản ứng xảy ra khi cho Zn + HNO3 loãng
Nhiệt độ thường
4. Bài tập vận dụng liên quan
Câu 1. Hệ số của HNO3 trong phản ứng:
Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O (biết tỉ lệ mol của N2O : N2 = 2 : 3) là
A. 55.
B. 56.
C. 70.
D. 50.
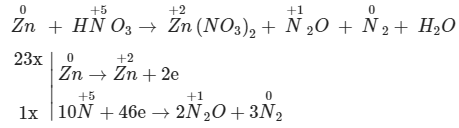
Vì tỉ lệ mol của N2O : N2 là 2 : 3 => đặt 2 trước N2O và đặt 3 trước N2 sau đó tính tổng eletron nhận = 10.5 – 2.2.1 – 0 = 46
Chọn hệ số sao cho tổng electron cho = tổng elron nhận => nhân 23 ở quá trình cho eletron và nhân 1 ở quá trình nhận eletron
23Zn + 56HNO3 → 23Zn(NO3)2 + 2N2O + 3N2 + 28H2O
Câu 2. Cho phương trình hoá học: Zn + HNO3 → Zn(NO3)2 + N2 + H2O
Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là
A. 26
B. 28
C. 27
D. 29
Câu 3. Hòa tan hoàn toàn 6,5 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,224 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là
A. 18,90 gam.
B. 17,80 gam.
C. 19,9 gam.
D. 28,35 gam.
nZn = 6,5/65 = 0,1 (mol); nN2= 0,224/22,4 = 0,01 (mol)
Ta thấy:
necho= 2nZn = 0,4 (mol) > ne nhận = 10nN2 = 0,2 (mol) → Sản phẩm khử có chứa NH4NO3
Quá trình cho – nhận e:
0Zn → Zn+2 + 2e +5N + 10e → 20N(N2)
2+5N + 8e→−3N (NH4NO3)
Áp dụng bảo toàn e:
2nZn = 10nN2 + 8nNH4NO3
⇔ 2.0,1 = 10.0,01 + 8nNH4NO3 ⇔ nNH4NO3 = 0,0125 (mol)
Muối trong dung dịch X gồm: 0,1 mol Zn(NO3)2 và 0,025 mol NH4NO3
→ mmuối = 0,1.189 + 0,0125.80 = 19,9 gam
Câu 4. Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí X duy nhất (đktc). Cô cạn dung dịch X thu được 39,8 gam chất rắn. Khí X là:
A. NO2
B. N2
C. N2O
D. NO
Chất rắn khan thu được chứa Zn(NO3)2 và có thể có NH4NO3.
Ta có: nZn(NO3)2 = nZn = 0,2 mol
Giả sử 1 phân tử khí trao đổi n electron.
BT electron: n e cho = n e nhận => 2nZn = 8nNH4NO3 + n.n khí => 2.0,2 = 8.0,025 + n.0,02
=> n = 10 => X là N2
Câu 5. Nhiệt phân hoàn toàn 17,0 gam AgNO3 thu được a gam kim loại. Giá trị của a là
A. 2,7 gam.
B. 10,8 gam.
C. 5,4 gam.
D. 13,5 gam.
Câu 6. Cho 1,12 lít khí N2 tác dụng với 4,48 lít khí H2 tạo ra V lít khí NH3 (điều kiện tiêu chuẩn). Biết hiệu suất phản ứng là 25%. Tính giá trị của V?
A. 2,24 lít
B. 5,6 lít
C. 0,56 lít
D. 1,12 lít
Phương trình hóa học:
Phản ứng: N2 + 3H2 → 2NH3
Ban đầu: 0,05 0,2 mol
(So sánh thấy: 0,05/1 < 0,2/3 nên hiệu suất tính theo N2 => nN2 pư = 0,05.25% = 0,0125 mol)
N2 + 3H2 → 2NH3
0,0125 → 0,0375 → 0,025
→ V = 0,025.22,4 = 0,56 lít
Câu 7. Điểm giống nhau giữa khí nito và khí cacbonic là:
A. Đều không tan trong nước
B. Đều có tính Oxi hóa và tính khử
C. Đều không duy trì sự cháy và sự sống
D. Tất cả đáp án trên đều đúng
Câu 8. Cho các câu sau nói về tính chất của nito:
1) Hóa lỏng ở nhiệt độ rất thấp (-1960C)
2) Có khả năng đông nhanh
3) Tan nhiều trong nước
4) Nặng hơn Oxi
5) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
Tìm các tính chất không thuộc về khí nitơ?
A. (1); (3); (4)
B. (1); (2)
C. (3); (4); (5)
D. (2); (3); (5)
3) Tan nhiều trong nước
4) Nặng hơn Oxi
5) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
Câu 9. Cho hổn hợp X gồm 0,05 mol Cu; 0,1 mol Zn; 0,15 mol Al vào 500 ml dung dịch HCl. Phản ứng kết thúc thu được dung dịch Y và hổn hợp rắn Z. Cho Z và dung dịch HNO3 có dư thu được 2,24 lít NO (đktc). Tìm nồng độ dung dịch HCl
A. 1,8M
B. 3M
C. 0,9M
D. 2,5M
Các quá trình trao đổi electron là:
Quá trình cho e
Cu → Cu2+ + 2e
Zn → Zn2+ + 2e
Al → Al3+ + 3e
Quá trình nhận e
2H+ + 2e → H2
N+5 + 3e → N+2
Áp dụng bảo toàn electron ta có
2nCu + 2nZn + 3nAl = nHCl + 3nNO
=> 2.0,05 + 2.0,1 + 3.0,15 = nH+ + 3.0,1 => nH+ = 0,45 mol
⇒ nHCl = 0,45 mol ⇒ CM HCl = 0,9M
Câu 10. Cho dung dịch NH3 đến dư vào dung dịch chứa AlCl3 và ZnCl2 thu được kết tủa A. Nung A được chất rắn B. Cho luồng hiđro đi qua B nung nóng sẽ thu được chất rắn nào trong số các chất sau?
A. Zn và Al2O3.
B. Al và Zn.
C. Al2O3.
D. Al và ZnO.
AlCl3 + 3NH3 + 6H2O → Al(OH)3 + 3NH4Cl
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2 + NH3 dư → [Zn(NH3)6](OH)2
Câu 11. Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 56,7 gam Zn(NO3)2 và 4 gam NH4NO3. Phần trăm khối lượng Zn trong X là
A. 33,33%
B. 66,67%
C. 61,61%
D. 50,00%
nZn(NO3)2 = 0,3 mol;
nNH4NO3 = 0,05 mol
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,05 = 0,2 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO
=> nZnO = 0,3 – 0,2 = 0,1 mol
%mZn = 0,2.65/(0,2.65 + 0,1.81).100% = 61,61%
Câu 12. Cho m (g) hỗn hợp Mg, Al, Zn tác dụng với 0,112 lit Cl2 ở đktc, phản ứng xảy ra hoàn toàn thu được chất rắn X. Cho X tác dụng với dung dịch axit HCl dư thu được dung dịch Y và 0,168 lit H2 đktc. Làm khô dung dịch Y thu được 1,245 gam chất rắn khan. m có giá trị là:
A. 0,3575
B. 1,4300
C. 2,1400
D. 0,7150
nCl2 = 0,005 mol
nH2 = 0,0075 mol
nCl– = 2nCl2 + 2nH2 = 0,025 mol
Bảo toàn khối lượng: mmuối = mKL + mCl–
=> 1,245 = mKL+ mCl– = m + 0,025.35,5
=> m= 0,3575 g
Câu 13. Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4 loãng?
A. Al, Mg, Cu
B. Fe, Mg, Ag
C. Al, Fe, Mg
D. Al, Fe, Cu
Câu 14. Cho hỗn hợp gồm 1 mol chất A và 1 mol chất B tác dụng hết với dung dịch H2SO4 đăc, nóng (dư) tạo ra 1 mol khí SO2 (sản phẩm khử duy nhất). Hai chất A, B là
A. Fe, Fe2O3
B. Fe, FeO
C. Fe3O4, Fe2O3
D. FeO, Fe3O4
Xét quá trình cho – nhận e:
Cho e:
Fe: Fe0→Fe+3 + 3e
FeO: +2Fe →+3Fe + 1e
Fe3O4: +8/3Fe3 →3+3Fe + 1e
Nhận e: S+6→S+4 + 2e
A. FeO, Fe3O4 : nSO2 = (1+1)/2 = 1 mol
B. Fe3O4, Fe2O3: nSO2 = 1/2 = 0,5 mol
C. Fe, Fe2O3: nSO2= 3/2= 1,5mol
D. Fe, FeO: nSO2 = (3 + 1)/2 = 2 mol
————————————–
Mời các bạn tham khảo một số tài liệu liên quan
Tmdl.edu.vn đã gửi tới bạn Zn + HNO3 → Zn(NO3)2 + N2 + H2O được Tmdl.edu.vn biên soạn. Nội dung tài liệu giúp các bạn biết cách viết và cân bằng phương trình phản ứng khi cho Zn tác dụng với HNO3 loãng, từ đó có thể nhận biết hiện tượng sau phản ứng.
Các bạn có thể các em cùng tham khảo thêm một số tài liệu liên quan hữu ích trong quá trình học tập như: Giải bài tập Hóa 12, Giải bài tập Toán lớp 12, Giải bài tập Vật Lí 12 ,….
Ngoài ra, Tmdl.edu.vn đã thành lập group chia sẻ tài liệu ôn tập THPT Quốc gia miễn phí trên Facebook: Tài liệu học tập lớp 12 Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu, đề thi mới nhất.
Bản quyền bài viết thuộc trường Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: Trường Tmdl.edu.vn (tmdl.edu.vn)
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục