Các công thức Hóa Học lớp 10 Hk1 Hk2 đầy đủ
Chương trình môn Hóa học lớp 10 mang đến cho các em những kiến thức về Hóa đại cương và một phần Hóa học vô cơ. Khi học chương trình này em sẽ biết cấu tạo của nguyên tử, nguyên tố hóa học, quy tắc sắp xếp nguyên tố hóa học, tốc độ phản ứng, đặc điểm và tính chất các nguyên tố phi kim,… Dưới đây là bài viết tổng hợp tất cả các công thức hóa học lớp 10 đầy đủ nhất theo phân bổ chương trình đào tạo.
Nội dung chính
Bạn đang xem bài: Các công thức Hóa Học lớp 10 Hk1 Hk2 đầy đủ
Chương trình hóa học lớp 10
- Chương 1: Nguyên Tử
- Chương 2: Bảng Tuần Hoàn Các Nguyên Tố Hóa Học Và Định Luật Tuần Hoàn
- Chương 3: Liên Kết Hóa Học
- Chương 4: Phản Ứng Oxi Hóa Khử
- Chương 5: Nhóm Halogen
- Chương 6: Oxi – Lưu Huỳnh
- Chương 7: Tốc Độ Phản Ứng Và Cân Bằng Hóa Học
Chương 1: Nguyên tử
Số đơn vị điện tích hạt nhân = số proton = số electron. Z = P = E
Số khối A của hạt nhân: là tổng số proton Z và số nơtron N. A = Z + N
Chương 2: Bảng tuần hoàn và định luật tuần hoàn các nguyên tố hóa học
Chương này các em chủ yếu tính toán số proton, nowtron, electron của nguyên tử và tính phần trăm.
Chương 3: Liên kết hóa học
Ta có: 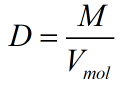
Thể tích của nguyên tử là Vmol
Tính thể tích của 1 nguyên tử:
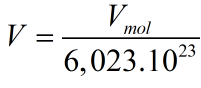
Thể tích thực là: Vt=V.74
Từ công thức 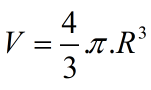 ta tìm được R là bán kính nguyên tử.
ta tìm được R là bán kính nguyên tử.
Chương 4: Phản ứng oxi hóa-khử
Cân bằng phương trình oxi hóa-khử bằng phương pháp thăng bằng electron. Chương này gồm 2 dạng bài chính:
Dạng 1: Phản ứng oxi hóa – khử không có môi trường
Dạng 2: Phản ứng oxi hóa – khử có môi trường
Chương 5: Nhóm Halogen
Phương pháp trung bình: Với hợp chất muối MX ta có: mMX = mM + mX
Phương pháp bảo toàn nguyên tố: Ví dụ ta có nCl = nhCl = 2nh2
Phương pháp tăng giảm khối lượng: Thường dựa vào khối lượng kim loại phản ứng
Chương 6: Nhóm Oxi
Bài tập xác định thành phần hỗn hợp
Trường hợp xác định % khối lượng các chất A, B, C trong hỗn hợp.
Cách giải:
Gọi x, y, z lần lượt là số mol của các chất A, B, C trong hỗn hợp
–> mhh = xA + yB +zC (1)
Tuỳ theo dữ kiện đề bài ta tìm được å x + y +z (2)
Từ (1) và (2) lập phương trình toán học => đại lượng cần tìm.
Trường hợp xác định % theo thể tích
Cách giải:
Giả sử hỗn hợp gồm 2 khí A, B
X là số mol khí A g số mol khí B là (1-x) wsng với một hỗn hợp khí.
Chương 7: Tốc độ phản ứng và cân bằng hóa học
Biểu thức vận tốc phản ứng:
Xét phản ứng: mA + nB → pC + qD
Biểu thức vận tốc: v= k.(A)m.(B)n
Với k là hằng số tỉ lệ (hằng số vận tốc
(A), (B) là nồng độ mol chất A, B.
Bài tập vận dụng
Câu 1: Nguyên tử X có 26 proton trong hạt nhân. Chọn số phát biểu đúng trong các phát biểu sau về X:
- X có 26 nơtron trong hạt nhân.
- X có 26 electron ở vỏ nguyên tử.
- X có điện tích hạt nhân là 26+.
- Khối lượng nguyên tử X là 26u.
Câu 2: Biết rằng nguyên tử crom có khối lượng 52u, bán kính nguyên tử bằng 1,28 Å. Khối lượng riêng của nguyên tử crom là bao nhiêu?
- 2,47 g/cm3.
- 9,89 g/cm3.
- 5,20 g/cm3.
- 5,92 g/cm3.
Câu 3: Cho biết Oxit ứng với hóa trị cao nhất của nguyên tố R có công thức R2O5. Trong hợp chất của nó với hidro, R chiếm 82,35% về khối lượng. R là nguyên tố
- N
- P
- Na
- Mg
Câu 4: Hai nguyên tố M và X tạo ra hợp chất công thức hoa học là M2X. Biết rằng: Tổng số proton trong hợp chat M2X bằng 46. Trong hạt nhân M có n – p = 1, hạt nhân của X có n’ = p’. Trong hợp chất M2X, nguyên tố X chiếm 8/47 khối lượng phân tử. Số hạt proton trong hạt nhân nguyên tử M, X và liên kết trong hợp chất M2X lần lượt là bao nhiêu? Chọn đáp án đúng trong các câu trả lời sau:
- 19, 8 và liên kết cộng hóa trị
- 19, 8 và liên kết ion
- 15, 16 và liên kết ion
- 15, 16 và liên kết cộng hóa trị
Câu 5: Cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng lượng dư dung dịch HCl đặc, chất nào sẽ tạo ra khí Cl2 nhiều nhất trong các chất dưới đây.
- CaOCl2
- KMnO4
- K2Cr2O7
- MnO2
Câu 6: Cho 3,16 gam chất KMnO4 tác dụng cùng với dung dịch HCl đặc (dư), số mol HCl sau phản ứng bị oxi hóa bao nhiêu? Chọn đáp án chính xác bên dưới:
- 0,05
- 0,16
- 0,02
- 0,10
Câu 7: Khi đốt cháy hoàn toàn 7,2 gam kim loại tên gọi M (có hóa trị II không đổi trong hợp chất) trong khí Cl2 dư, người ta thu 28,5 gam muối. Kim loại M là kim loại nào trong các chất bên dưới:
- Be
- Cu
- Ca
- Mg
Câu 8: Cho 69,6 gam mangan đioxit tác dụng cùng với dung dịch axit clohidric đặc. Toàn bộ lượng khí clo sinh ra được hấp thu hết vào 500 ml dung dịch NaOH 4M, thu 500 ml dung dịch X. Nồng độ mol NaCl và NaOH dung dịch X là bao nhiêu trong các kết quả dưới đây?
- 1,6M và 0,8M
- 1,6M và 1,6M
- 3,2M và 1,6M
- 0,8M và 0,8M
Câu 9: Dẫn 4,48 lít hỗn hợp khí N2 và Cl2 vào dung dịch Ca(OH)2 dư. Sau phản ứng xảy ra hoàn toàn, còn lại 1,12 lít khí thoát ra. Tính phần trăm thể tích của Cl2 trong hỗn hợp trên (Chọn đáp án chính xác nhất trong các câu sau)
- 88,38%
- 75,00%
- 25,00%
- 11,62%
Câu 10: Cho hấp thụ hoàn toàn 2,24 lít khí Cl2 (đktc) vào 200 ml dung dịch NaOH (ở nhiệt độ thường). Nồng độ NaOH còn lại sau phản ứng là 0,5M (giả thiết thể tích dung dịch không thay đổi). Nông độ mol ban đầu của dung dịch NaOH là
- 0,5M
- 0,1M
- 1,5M
- 2,0M
Câu 11: Trong một loại nước clo ở 25℃, người ta xác định được nồng độ của clo là 0,06M, còn nồng độ của HCl và HClO là 0,03M. Thể tích khí clo (đktc) cần dùng để điều chế 5 lít nước clo trên là bao nhiêu?
- 6,72 lít.
- 3,36 lít.
- 10,08 lít.
- 13,44 lít.
Câu 12: Hỗn hợp X gồm các hợp chất KClO3, Ca(ClO3)2, CaCl2 và KCl có khối lượng 82,3 gam. Nhiệt phân hoàn toàn X thu được 13,44 lít O2 (đktc), chất rắn Y gồm CaCl2 và KCl. Toàn bộ Y tác dụng vừa đủ với 0,3 lít dung dịch K2CO31M thu được dung dịch Z. Biết rằng lượng KCl trong Z nhiều gấp 5 lần lượng KCl trong X.Tính thành phần phần trăm khối lượng KCl trong X
- 25,62%
- 12,67%
- 18,10%
- 29,77%
Câu 13: Thực hiện phản ứng trong hai cốc:
Cốc (1): 25 ml H2SO4 0,1M và 25 ml dung dịch Na2S2O2 0,1M;
Cốc (2): 25 ml H2SO4 0,1M và 10 ml dung dịch Na2S2O2 0,1M và 15 ml H2O. Sau đó dùng đũa thủy tinh khuấy nhẹ trong cả hai cốc. Chọn phát biểu đúng về hiện tượng xuất hiện trong hai cốc nước:
- Thời gian xuất hiện kết tủa trắng đục của cốc (1) ít hơn cốc (2)
- Thời gian xuất hiện kết tủa trắng đục của cốc (2) ít hơn cốc (1)
- Thời gian xuất hiện kết tủa xanh nhạt của cốc (2) ít hơn cốc (1)
- Thời gian xuất hiện kết tủa xanh nhạt của cốc (1) ít hơn cốc (2)
Từ đây chương trình Hóa học lớp 10 có khá nhiều lý thuyết cần nhớ và nhiều dạng bài tập cần làm thành thạo. Vì thế các em cần nắm chắc từ lý thuyết và bài tập cơ bản để có thể làm đến các bài tập nâng cao hơn. Mong rằng những công thức hóa học lớp 10 này sẽ giúp các em thành thạo được các dạng bài tập cơ bản.
Bản quyền bài viết thuộc Trường Trung Cấp Nghề Thương Mại Du Lịch Thanh Hoá. Mọi hành vi sao chép đều là gian lận!
Nguồn chia sẻ: https://tmdl.edu.vn https://tmdl.edu.vn/cac-cong-thuc-hoa-hoc-lop-10-hk1-hk2-day-du/
Trang chủ: tmdl.edu.vn
Danh mục bài: Giáo dục





